
Efeitos de substituição nucleofílica aromática, exemplos
O substituição nucleofílica aromática (SNAr) é uma reação que ocorre na química orgânica, que consiste no deslocamento de um bom grupo de saída por um nucleófilo que chega. Do ponto de vista de seu mecanismo e aspectos eletrônicos, é o lado oposto da substituição eletrofílica aromática (SEAr)..
Geralmente, o grupo de saída é um halogênio, que surge como um ânion haleto X-. Essa reação só pode ocorrer se o anel aromático (principalmente benzeno) for deficiente em elétrons; isto é, se ele tiver grupos substituintes que retiram elétrons.

A imagem superior descreve o que foi dito no parágrafo anterior. O grupo atrator de elétrons EWG (por sua sigla em inglês: Grupo de Retirada de Elétrons), ativa o anel aromático para o ataque nucleofílico da espécie negativa Nu-. Pode-se ver que um intermediário é formado (no centro), a partir do qual o haleto X é liberado ou sai-.
Observe que, em termos simples, X é substituído por Nu em um anel aromático. Esta reação é muito versátil e necessária na síntese de novos fármacos, bem como nos estudos de química orgânica sintética..
Índice do artigo
- 1 Aspectos gerais
- 1.1 Diferenças com a substituição eletrofílica aromática
- 2 efeitos
- 2.1 Do número de substituintes
- 2.2 Do grupo de saída
- 3 exemplo
- 3.1 Comentário final
- 4 referências
Aspectos gerais
O anel aromático pode ser "carregado" ou "descarregado" de elétrons, dependendo de quais são seus substituintes (aqueles que substituem a ligação C-H original).
Quando esses substituintes podem doar densidade de elétrons ao anel, diz-se que eles o enriquecem com elétrons; Se, ao contrário, eles são atratores de densidade de elétrons (o EWG mencionado acima), então é dito que eles empobrecem o anel de elétrons.
Em ambos os casos, o anel é ativado para uma reação aromática específica, enquanto é desativado para a outra..
Por exemplo, diz-se que um anel aromático rico em elétrons é ativo para substituição aromática eletrofílica; ou seja, ele pode doar seus elétrons para uma espécie eletrofílica, E+. No entanto, não vai doar elétrons para uma espécie Nu-, uma vez que cargas negativas se repelem.
Agora, se o anel é pobre em elétrons, não há como dá-los à espécie E+ (SEAr não ocorre); por outro lado, tem disponibilidade para aceitar os elétrons da espécie Nu- (o SNAr é desenvolvido).
Diferenças com substituição eletrofílica aromática
Uma vez que os aspectos gerais de entrada tenham sido esclarecidos, algumas diferenças entre o SNAr e o SEAr podem agora ser listadas:
- O anel aromático atua como um eletrófilo (deficiente em elétrons) e é atacado por um nucleófilo.
- Um grupo de saída X é substituído no anel; não um H+
- Carbocações não são formadas, mas intermediários com uma carga negativa que pode ser deslocalizada por ressonância
- A presença de mais grupos atratores no anel acelera a substituição em vez de desacelerá-la
- Finalmente, esses grupos não têm efeitos direcionadores sobre onde (em qual carbono) a substituição ocorrerá. A substituição sempre ocorrerá no carbono anexado ao grupo de saída X.
O último ponto também é ilustrado na imagem: a ligação C-X se quebra para formar a nova ligação C-Nu.
Edição de efeitos
Do número de substituintes
Naturalmente, quanto mais pobre em elétrons for o anel, mais rápido será o rSNA e menos drásticas serão as condições necessárias para que ele ocorra. Considere o seguinte exemplo representado na imagem abaixo:
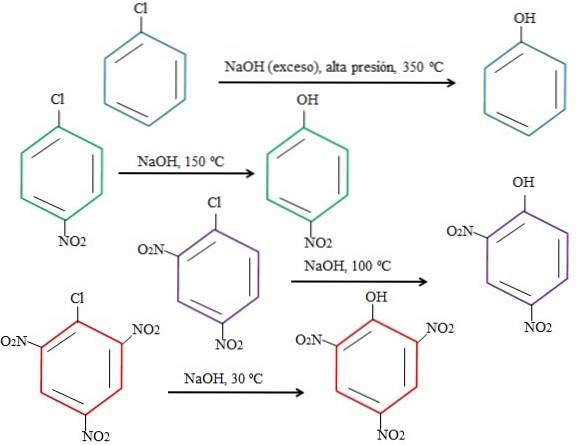
Observe que o 4-nitroclorobenzeno (anel azul) requer condições drásticas (alta pressão e temperatura de 350 ºC) para que ocorra a substituição do Cl por OH. Neste caso, o cloro é o grupo de saída (Cl-), e hidróxido o nucleófilo (OH-).
Quando o grupo NÃO aparecedois, que é um atrator de elétrons (anel verde), a substituição pode ser realizada a uma temperatura de 150 ° C à pressão ambiente. Conforme o número de grupos NÃO aumentadois presente (anéis roxos e vermelhos), a substituição ocorre em temperaturas mais baixas e mais baixas (100ºC e 30ºC, respectivamente).
Portanto, os grupos NÃO sãodois acelera rSNA e priva o anel de elétrons, tornando-o mais suscetível ao ataque de OH-.
As posições relativas de Cl em relação ao NÃO não serão explicadas aqui.dois em 4-nitroclorobenzeno, e como estes alteram a velocidade da reação; Por exemplo, as taxas de reação de 2-nitroclorobenzeno e 3-nitroclorobenzeno são diferentes, sendo o último o mais lento em comparação com os outros isômeros.
Do grupo de saída
Retomando o 4-nitroclorobenzeno, sua reação de substituição é mais lenta quando comparada à sua contraparte fluorada:
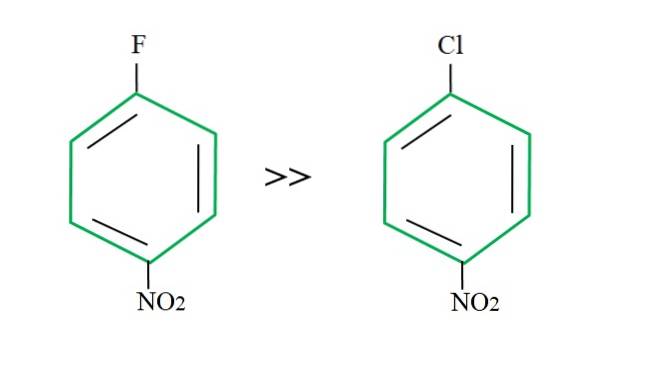
A explicação para isso não pode estar em qualquer outra variável que não a diferença entre F e Cl. O flúor é um péssimo grupo de saída, uma vez que a ligação C-F é mais difícil de quebrar do que a ligação C-Cl. Portanto, a quebra deste vínculo não é a etapa determinante da velocidade para o SNAr, mas a adição do Nu- para o anel aromático.
Como o flúor é mais eletronegativo do que o cloro, o átomo de carbono ligado a ele tem uma deficiência eletrônica maior (Cδ+-Fδ-) Consequentemente, o carbono da ligação C-F é muito mais suscetível a ser atacado por Nu- do que a ligação C-Cl. É por isso que a substituição de F por OH é muito mais rápida do que a de Cl por OH.
Exemplo
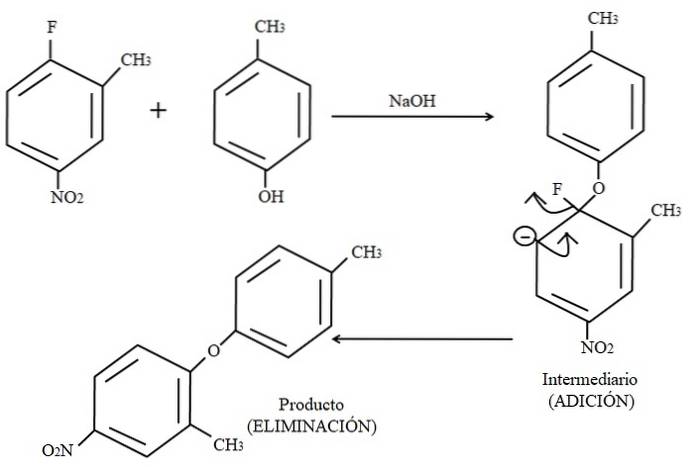
Finalmente, um exemplo deste tipo de reações orgânicas é mostrado abaixo na imagem acima. O para-cresol não parece ser um nucleófilo; mas como há um meio básico, seu grupo OH é desprotonado, deixando-o como um ânion fenóxido, que ataca o 2-metil-4-nitrofluorobenzeno.
Quando esse ataque ocorre, diz-se que o nucleófilo se soma ao eletrófilo (o anel aromático do 2-metil-4-nitrofluorobenzeno). Esta etapa pode ser vista à direita da imagem, onde o composto intermediário é formado com ambos os substituintes pertencentes ao anel.
Quando o para-cresol é adicionado, uma carga negativa aparece que é deslocalizada por ressonância dentro do anel (observe que ela deixa de ser aromática).
Apenas a última estrutura de ressonância é mostrada na imagem, a partir da qual o flúor termina como F-; mas, na realidade, essa carga negativa é deslocalizada até mesmo nos átomos de oxigênio do grupo NOdois. Após a etapa de adição, vem a etapa de eliminação, a última, que é quando o produto é finalmente formado.
Comentário final
O grupo NÃOdois remanescente pode ser reduzido ao grupo NHdois, e a partir daí é possível realizar mais reações de síntese para modificar a molécula final. Isso destaca o potencial sintético do rSNA, e que seu mecanismo também consiste em duas etapas: uma para adição e outra para eliminação..
Atualmente, entretanto, há evidências experimentais e computacionais de que a reação realmente ocorre de acordo com um mecanismo combinado, onde ambas as etapas ocorrem simultaneamente por meio de um complexo ativado e não de um intermediário..
Referências
- Morrison, R. T. e Boyd, R, N. (1987). Quimica Organica. 5ª Edição. Editorial Addison-Wesley Interamericana.
- Carey F. (2008). Quimica Organica. (Sexta edição). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Química orgânica. Aminas. (10ª edição). Wiley plus.
- Wikipedia. (2019). Substituição nucleofílica aromática. Recuperado de: en.wikipedia.org
- James Ashenhurst. (6 de setembro de 2019). Substituição Nucleofílica Aromática (NAS). Recuperado de: masterorganicchemistry.com
- Chemistry LibreTexts. (5 de junho de 2019). Substituição Nucleofílica Aromática. Recuperado de: chem.libretexts.org


Ainda sem comentários