
Fórmulas, usos e riscos de sulfeto de sódio
O sulfeto de sódio (Na2S) é um sólido cristalino amarelo a vermelho tijolo. Na natureza é encontrado em diferentes graus de hidratação, sendo o mais comum o sulfeto de sódio nonahidratado (Na2S 9H2O).
Eles são sais solúveis em água que fornecem soluções fortemente alcalinas. Quando expostos ao ar úmido, eles absorvem a umidade do ar, podendo se aquecer espontaneamente e causar a ignição de materiais combustíveis próximos. Da mesma forma, em contato com o ar úmido, emitem sulfeto de hidrogênio, que cheira a ovo podre..

Eles são fortes agentes redutores. Essas substâncias podem ser perigosas para o meio ambiente, especialmente para organismos aquáticos.
O monossulfeto de sódio é fornecido comercialmente na forma de flocos contendo 60-62% de NadoisS ...
- Fórmulas

- CAS: 1313-82-2 Sulfeto de sódio (anidro)
- CAS: 1313-84-4 Sulfeto de sódio (não hidratado)
Estrutura 2D
Estrutura 3D

Características do sulfeto de sódio
Propriedades físicas e químicas

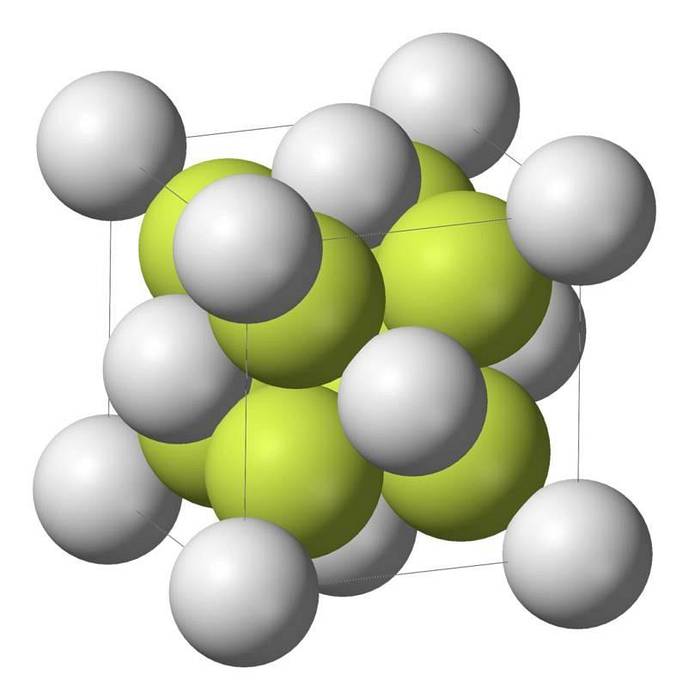
O monossulfeto de sódio (Na2S) cristaliza com a estrutura do antifluorito, na qual cada átomo de S é circundado por um cubo de 8 átomos de Na e cada átomo de Na por um tetraedro com 4 átomos de S..
Inflamabilidade
O único membro altamente inflamável do grupo sulfeto inorgânico é o sulfeto de hidrogênio. No entanto, alguns outros sulfetos inorgânicos, como o sulfeto de sódio, podem se aquecer espontaneamente e até mesmo inflamar se expostos à umidade..
Quando exposto ao fogo, o sulfeto de sódio libera gases ou vapores de dióxido de enxofre, que são irritantes ou tóxicos.
Reatividade
- Sulfetos inorgânicos são geralmente básicos (alguns são fortemente básicos e, portanto, incompatíveis com ácidos).
- Muitos desses compostos são agentes redutores (eles reagem vigorosamente com agentes oxidantes).
- Sais de sulfeto simples (como sulfeto de sódio, potássio e amônio) reagem vigorosamente com ácidos para liberar gás sulfeto de hidrogênio altamente tóxico e inflamável..
- O sulfeto de sódio é inflamável. Pode explodir quando aquecido rapidamente ou atingir.
- Quando aquecido até a decomposição, emite vapores tóxicos de óxido de sódio e óxidos de enxofre.
- Reage violentamente com carbono, carvão, sais de diazônio, N, N-diclorometilamina, oxidantes fortes e água.
Toxicidade
Muitos dos membros do grupo do sulfeto inorgânico se comportam como bases fortes e podem causar queimaduras graves em contato com a pele..
Esta propriedade depende de sua solubilidade. Os sulfetos inorgânicos mais insolúveis (por exemplo, sulfeto de mercúrio (II) e sulfeto de cádmio) não são cáusticos.
O sulfeto de sódio tem um coeficiente de partição octanol / água médio (Pow) (de -3,5). Este valor é usado como uma medida da solubilidade (e bioconcentração) de uma substância em tecidos adiposos de animais (especialmente animais aquáticos)..
O sulfeto de sódio é considerado perigoso para o meio ambiente, especialmente para organismos aquáticos.
Formulários
Em casa, o sulfeto de sódio é usado em limpadores de ralos, limpadores domésticos (para forno, banheiro), alisadores de cabelo, sabão para lava-louças e airbags de automóveis..
Na indústria, é usado em produtos de limpeza, em cimento e como precursor na produção de outros produtos químicos.
Efeitos clínicos
A exposição ao sulfeto de sódio é comum em países desenvolvidos e subdesenvolvidos, tanto na indústria quanto em casa. Essas substâncias corrosivas estão presentes em vários produtos domésticos em baixas concentrações..
Em países desenvolvidos, os efeitos graves são raros. Estes ocorrem principalmente por ingestão deliberada do produto químico em adultos. No entanto, nos países em desenvolvimento, os efeitos graves são mais comuns.
Os corrosivos alcalinos causam necrose de liquefação. Eles saponificam as gorduras da membrana celular, destruindo a célula e permitindo uma penetração profunda no tecido da mucosa.
Exposição oral
A inflamação inicial ocorre no tecido gastrointestinal, seguida por necrose do tecido (com possível perfuração), depois granulação e, finalmente, formação de estenose.
Pacientes com ingestão leve desenvolvem irritação grau I ou queimaduras (hiperemia superficial e edema) da orofaringe, esôfago ou estômago..
Pacientes com intoxicação moderada podem desenvolver queimaduras de grau II (bolhas superficiais, erosões e ulcerações) com possível formação de estenose subsequente (particularmente esofágica)..
Alguns pacientes (especialmente crianças) podem desenvolver edema respiratório superior.
Pacientes com intoxicação grave por ingestão podem desenvolver queimaduras profundas e necrose da mucosa gastrointestinal, com complicações como: perfuração (esofágica, gástrica, raramente duodenal), formação de fístula (traqueoesofágica, aorto-fágica) e sangramento gastrointestinal..
Pode desenvolver: hipotensão, taquicardia, taquipnéia, formação de estenose (principalmente esofágica), carcinoma esofágico e edema respiratório superior (que é comum e muitas vezes com risco de vida).
A intoxicação grave geralmente é limitada a ingestões deliberadas em adultos.
Exposição à inalação
A exposição leve pode causar tosse e broncoespasmo.
A inalação severa pode causar edema respiratório superior, queimaduras, estridor e, raramente, lesão pulmonar aguda..
Exposição ocular
Pode causar irritação conjuntival grave e quemose, defeitos epiteliais da córnea, isquemia límbica, perda visual permanente e em casos graves de perfuração.
Exposição dérmica
A exposição moderada causa irritação e queimaduras de espessura parcial. A acidose metabólica pode se desenvolver em pacientes com queimaduras graves ou choque..
A exposição prolongada ou produtos de alta concentração podem causar queimaduras de espessura total.
Segurança e Riscos
Declarações de perigo do Sistema Globalmente Harmonizado de classificação e rotulagem de produtos químicos (GHS)
O Sistema Globalmente Harmonizado de Classificação e Rotulagem de Produtos Químicos (GHS) é um sistema internacionalmente aceito, criado pelas Nações Unidas e projetado para substituir os vários padrões de classificação e rotulagem usados em diferentes países, usando critérios consistentes globalmente..
As classes de perigo (e seu capítulo correspondente do GHS), os padrões de classificação e rotulagem e as recomendações para o sulfeto de sódio são os seguintes (European Chemicals Agency, 2017; United Nations, 2015; PubChem, 2017):







Referências
- Benjah-bmm27, (2006). Fluorite-unit-cell-3D-ionic [imagem] Recuperado de: wikipedia.org.
- ChemIDplus, (2017). 1313-82-2 [imagem] Recuperado de: chem.nlm.nih.gov.
- ChemIDplus, (2017). Estrutura 3D de 1313-82-2 - Sulfeto de sódio [imagem] Recuperado de: chem.nlm.nih.gov.
- ChemIDplus, (2017). Estrutura 3D de 1313-84-4 - Sulfeto de sódio [imagem] Recuperado de: chem.nlm.nih.gov.
- Agência Europeia dos Produtos Químicos (ECHA). (2017). Resumo de classificação e rotulagem.
- Classificação harmonizada - Anexo VI do Regulamento (CE) n.º 1272/2008 (Regulamento CRE). Sulfeto de sódio. Retirado em 16 de janeiro de 2017, de: echa.europa.eu.
- Agência Europeia dos Produtos Químicos (ECHA). (2017). Resumo de classificação e rotulagem.
- Classificação e rotulagem notificadas. Sulfeto de sódio hidratado. Retirado em 16 de janeiro de 2017, de: echa.europa.eu.
- Banco de dados de substâncias perigosas (HSDB). TOXNET. (2017). Sulfeto de sódio. Bethesda, MD, EU: National Library of Medicine. Recuperado de: toxnet.nlm.nih.gov.
- Lange, L., & Triebel, W. (2000). Sulfetos, polissulfetos e sulfanatos. Na Enciclopédia de Química Industrial de Ullmann. Wiley-VCH Verlag GmbH & Co. KGaA. Recuperado de dx.doi.org.
- Nações Unidas (2015). Sistema Globalmente Harmonizado de Classificação e Rotulagem de Produtos Químicos (GHS) Sexta edição revisada. Nova York, UE: Publicação das Nações Unidas. Recuperado de: unece.org.
- Centro Nacional de Informações sobre Biotecnologia. PubChem Compound Database. (2016). Sulfeto de sódio eneaidratado - Estrutura PubChem [imagem] Obtido em: pubchem.ncbi.nlm.nih.gov.
- Centro Nacional de Informações sobre Biotecnologia. PubChem Compound Database. (2017). Monossulfeto de sódio. Bethesda, MD, EU: National Library of Medicine. Recuperado de: pubchem.ncbi.nlm.nih.gov.
- Centro Nacional de Informações sobre Biotecnologia. PubChem Compound Database. (2017). Sulfeto de sódio eneaidratado. Bethesda, MD, EU: National Library of Medicine. Recuperado de: pubchem.ncbi.nlm.nih.gov.
- Administração Oceânica e Atmosférica Nacional (NOAA). CAMEO Chemicals. (2017). Folha de dados química. Sulfeto de sódio anidro. Silver Spring, MD. EU; Recuperado de: cameochemicals.noaa.gov.
- Administração Oceânica e Atmosférica Nacional (NOAA). CAMEO Chemicals. (2017). Folha de dados do grupo reativo. Sulfetos Inorgânicos. Silver Spring, MD. EU; Recuperado de: cameochemicals.noaa.gov.
- Ondřej Mangl, (2007). Sulfid sodný - Na2S [imagem] Recuperado de: wikipedia.org.
- PubChem, (2016). Monossulfeto de sódio [imagem] Recuperado de: puchem.nlm.nih.gov.
- PubChem, (2016). Sulfeto de sódio eneaidratado [imagem] Recuperado de: puchem.nlm.nih.gov.
- Wikipedia. (2017). Coeficiente de partição octanol-água. Recuperado em 17 de janeiro de 2017, em: wikipedia.org.
- .



Ainda sem comentários