
Propriedades do silicato de cálcio, estrutura, obtenção, usos
O silicato de cálcio é o nome dado a um grupo de compostos químicos formados a partir de óxido de cálcio (CaO) e sílica (SiOdois) A fórmula geral desses compostos é xCaO • ySiOdois• zHdoisOU.
Eles são sólidos brancos ou amarelados. Podem ser anidros, ou seja, sem água (HdoisO) em sua estrutura, ou pode contê-lo. Eles fazem parte de vários tipos de minerais na natureza.

Os silicatos de cálcio são insolúveis em água, mas quando se juntam a ela, formam géis hidratados (materiais como a gelatina) que são muito duros, resistentes e quase impermeáveis ao curar.
Isso levou ao seu uso na indústria da construção, visto que são usados em cimento, tijolos e painéis isolantes de umidade. Eles também fazem parte de materiais para cicatrizar perfurações nos dentes e até foi estudado para usá-los na regeneração de ossos, ou seja, como um biomaterial..
Eles foram propostos para reduzir a poluição gerada por algumas indústrias metalúrgicas. Eles também são usados como geradores de fricção em freios e embreagens de veículos..
Índice do artigo
- 1 Estrutura
- 2 Nomenclatura
- 3 propriedades
- 3.1 Estado físico
- 3.2 Peso molecular
- 3.3 Ponto de fusão
- 3.4 Densidade
- 3.5 Solubilidade
- 3,6 pH
- 3.7 Outras propriedades
- 4 Obtendo
- 5 usos
- 5.1 Na obtenção de tijolos
- 5.2 Em cimento Portland
- 5.3 Para imobilizar resíduos radioativos
- 5.4 Como isolamento para edifícios
- 5.5 Para reduzir a poluição na indústria metalúrgica
- 5.6 Em biomateriais
- 5.7 Em biodentina
- 5,8 Outros aplicativos
- 6 referências
Estrutura
O silicato de cálcio pode conter uma quantidade variável de óxido de cálcio (CaO) e sílica (SiOdois) Sua fórmula geral é:
xCaO • ySiOdois• zHdoisOU
onde x, y e z são números que podem ter vários valores.
A quantidade de CaO deve estar entre 3% e 35% (em peso em base seca) e o teor de SiOdois Deve ser 50-95% (em peso em base seca). Podem ser anidros (sem água em sua estrutura, ou seja, z = 0 na fórmula) ou podem ser hidratados (com água é sua conformação).
Nomenclatura
- Silicato de cálcio
- Sal de cálcio de ácido silícico
- Óxido de cálcio e silício
Propriedades
Estado físico
Sólido branco ou esbranquiçado muito fino.
Peso molecular
Metassilicato de cálcio CaO • SiOdois ou CaSiO3 = 116,16 g / mol
Ponto de fusão
Metassilicato de cálcio CaSiO3 = 1540 ° C
Densidade
Metassilicato de cálcio CaSiO3 = 2,92 g / cc
Solubilidade
Insolúvel em água e etanol.
pH
Uma lama preparada com 5% de silicato de cálcio pode ter um pH de 8,4-12,5.
Outras propriedades
O silicato de cálcio pode ser hidratado (com água na molécula) ou anidro (sem água na molécula) com várias proporções de cálcio na forma de óxido de cálcio CaO e sílica na forma de dióxido de sílica SiOdois.
Possui alta capacidade de absorção de água. Metassilicato de cálcio (CaO • SiOdois ou CaSiO3) se destaca pelo brilho e alvura, baixa umidade, baixo teor de voláteis e boa absorção de óleo.

Entre os hidratos de silicato de cálcio estão aqueles formados pela adição de água ao Cadoissim5 e para Ca3sim5. Os produtos da hidratação desses dois compostos são os mais abundantes em certos tipos de cimento..
Obtendo
O silicato de cálcio é obtido de várias maneiras pela reação de material silicioso (como terra de diatomáceas) e compostos de cálcio (como o hidróxido de cálcio (Ca (OH)dois).
O silicato de cálcio pode ser preparado, por exemplo, calcinando óxido de cálcio (CaO) com sílica (SiOdois) a temperaturas elevadas.
Quando a reação é realizada em uma razão molar de 1: 1 (isso significa que há o mesmo número de moléculas de CaO como SiOdois) resulta em metassilicato de cálcio CaSiO3 o CaO • SiOdois:
CaO + SiOdois + calor → CaSiO3
Formulários
Na obtenção de tijolos
Com silicato de cálcio, unidades ou tijolos para construção são feitos. São obtidos com material silicioso fino e cal viva ou cal hidratada. Pigmentos inertes podem ser adicionados para dar ao tijolo uma cor diferente.
As unidades são moldadas sob pressão e curadas em autoclave (forno a vapor) a 170 ° C por 4-6 horas. Durante a cura, parte da cal reage com o material silicioso para formar um hidrato de silicato de cálcio, que mantém o tijolo unido..

No entanto, os tijolos de silicato de cálcio tendem a expandir e encolher mais do que os tijolos de argila, o que às vezes pode causar rachaduras na alvenaria..
Isso chamou a atenção e foram considerados potencialmente perigosos.
Em cimento Portland
Os silicatos de cálcio fazem parte do cimento Portland, que é um material amplamente utilizado na indústria da construção.
O cimento Portland é um cimento hidráulico produzido pela pulverização de materiais formados principalmente por silicatos de cálcio hidratados e sulfato de cálcio CaSO4 (elencar).

Endurece rapidamente devido à reação de hidratação que gera um gel de silicato de cálcio hidratado. Isso resulta em um material forte, denso e pouco permeável (que não deixa a água passar).
Os silicatos que contém são silicato tricálcico Ca3sim5 o 3CaO.SiOdois e silicato dicálcico Cadoissim4 ou 2CaO.SiOdois.
Para imobilizar lixo radioativo
Os silicatos de cálcio no cimento podem variar em sua porcentagem em peso. A composição do cimento Portland pode mudar dependendo do tipo de estrutura de construção a que se destina..
Alguns tipos desse cimento são utilizados para imobilizar resíduos radioativos de forma que não causem danos às pessoas ou ao meio ambiente..
Como isolamento para edifícios
O silicato de cálcio é usado para obter placas de espuma mineral ou placas minerais isolantes.

Eles servem para isolar as paredes da umidade. CaO e SiO são misturadosdois com água e adiciona-se 3-6% de celulose, o que melhora a flexibilidade e estabilidade das bordas.
O lodo resultante é despejado em moldes e então aquecido com vapor em alta pressão e temperatura em um forno a vapor especial chamado autoclave..
O resultado é uma espuma rígida, de poros muito finos, que é cortada em folhas ou placas e tratada com aditivos especiais para que possa repelir a água..
A espuma de silicato de cálcio é utilizada no setor da construção, especialmente para isolar paredes e melhorar a proteção contra a umidade, sendo útil principalmente na reforma de edifícios antigos..
Para reduzir a poluição na indústria metalúrgica
Silicato dicálcico Cadoissim4 ou 2CaO.SiOdois encontrado na escória ou resíduo da produção de aço tem sido usado para precipitar metais dissolvidos em efluentes ácidos de outros processos metalúrgicos.
Precipitação significa que o metal dissolvido se torna parte de um composto sólido que vai para o fundo do recipiente e pode ser coletado.

O CAdoissim4 presente na escória de aço reage com a água e produz Ca (OH)dois que tem a capacidade de neutralizar a acidez de soluções ácidas de metais de outros processos:
2 Cadoissim4 + 4 hdoisO → 3CaO.2SiOdois.3HdoisO + Ca (OH)dois
Além de neutralizar, o composto de silicato de cálcio pode adsorver alguns dos íons metálicos Mdois+ por troca com o íon cálcio Cadois+. Aqui está um esboço:
≡Si-O-Ca + Mdois+ → ≡Si-O-M + Cadois+
O composto sólido contendo o metal pode então ser usado para outro propósito e não é descartado. Este é um exemplo de ecologia industrial.
Em biomateriais
Cerâmicas de silicato de cálcio começaram a ser testadas como biomateriais desde 1990. Elas têm sido estudadas quanto ao seu potencial de uso na regeneração de tecido ósseo devido à sua bioatividade superior a outros materiais..
Isso é atribuído ao fato de possuírem silício (Si), que desempenha um papel essencial nos mecanismos que levam à formação de novo osso..
Os cimentos à base de silicato de cálcio têm a capacidade de induzir a formação de um revestimento de fosfato de cálcio / apatita quando imersos em fluidos biológicos e promover a regeneração do tecido..
Por essas razões está sendo considerado um material adequado para reparo ósseo..
Na biodentina
O silicato de cálcio faz parte da biodentina. Trata-se de um material utilizado para reparar perfurações dentárias, reabsorções ósseas e como obturação de pontas de raízes dentárias..
O Biodentine é um cimento bioativo de baixa porosidade que possui maior resistência mecânica ou dureza do que outros materiais e se assemelha à dentina.
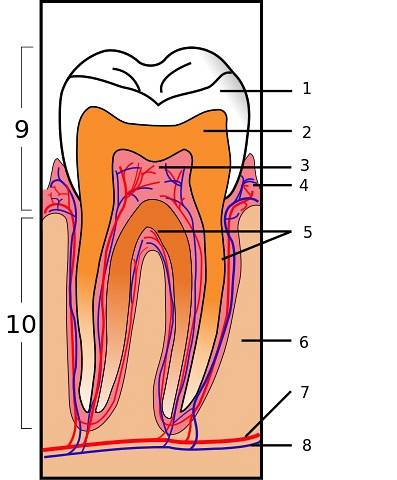
É feito de silicato tricálcico (Ca3sim5), silicato dicálcico (Cadoissim5), carbonato de cálcio (CaCO3) e óxido de zircônio. Quando misturados com água, os silicatos de cálcio formam um gel hidratado pegajoso que depois de um tempo se solidifica criando uma estrutura rígida..
Tem efeito positivo nas células da polpa dentária e acelera a formação de pontes na dentina, onde se destacam a resistência de suas ligações, sua microdureza e resistência à compressão..
Outros aplicativos
Os silicatos de cálcio também são usados como agentes antiaglomerantes e auxiliares de filtragem..
Metassilicato de cálcio CaSiO3 usado em cerâmica, em dispositivos onde o atrito é necessário, como freios e embreagens de veículos, e na obtenção de metais.
Devido ao seu alto brilho e alvura, CaSiO3 É usado para preencher tintas e plásticos.
Referências
- Ropp, R.C. (2013). Grupo 14 (C, Si, Ge, Sn e Pb) Compostos Alcalinos Terrestres. Silicatos de cálcio. Em Encyclopedia of the Alkaline Earth Compounds. Recuperado de sciencedirect.com.
- FAO (2015). Silicato de cálcio. Especificações preparadas na década de 80º JECFA (2015) e publicado na FAO JECFA Monographs 17. Obtido em fao.org.
- Harrisson, A.M. (2019). Constituição e especificações do cimento Portland. Hidrato de Silicato de Cálcio. Na Química do Cimento e Concreto de Lea (Quinta Edição). Recuperado de sciencedirect.com.
- Gellert, R. (2010). Materiais minerais inorgânicos para isolamento em edifícios. Espuma de silicato de cálcio e espuma mineral. Em Materiais para Eficiência Energética e Conforto Térmico em Edifícios. Recuperado de sciencedirect.com.
- Goudouri, O-M. et al. (2016). Caracterizando o comportamento de degradação de scaffolds biocerâmicos. Andaimes de apatita / wollastonita. Em Characterization and Design of Tissue Scaffolds. Recuperado de sciencedirect.com.
- Rani, P. et al. (2019). Nanocompósitos de capeamento da polpa dentária. Biodentin. Em Aplicações de Materiais Nanocompósitos em Odontologia. Recuperado de sciencedirect.com.
- Ingham, J.P. (2013). Produtos de concreto. Unidades de silicato de cálcio. Em Geomaterials Under the Microscope. Recuperado de sciencedirect.com.
- Ojovan, M.I. e Lee, W.E. (2005). Imobilização de Resíduos Radioativos em Cimento. Cimentos Hidráulicos. Em uma introdução à imobilização de resíduos nucleares. Recuperado de sciencedirect.com.
- Ramachandra Rao, S. (2006). Recuperação e reciclagem de recursos de resíduos metalúrgicos. Silicato de cálcio como precipitante de metais dissolvidos. Na série de gerenciamento de resíduos. Recuperado de sciencedirect.com.
- Prati, C. e Gandolfi, M.G. (2015). Cimentos bioativos de silicato de cálcio: Perspectivas biológicas e aplicações clínicas. Dent Mater, abril de 2015; 31 (4): 351-70. Recuperado de ncbi.nlm.nih.gov.


Ainda sem comentários