
Descoberta de raios anódicos, propriedades

O raios anódicos ou raios do canal, Também chamados de positivos, eles são feixes de raios positivos compostos de cátions atômicos ou moleculares (íons carregados positivamente) que são direcionados ao eletrodo negativo em um tubo de Crookes.
Os raios anódicos se originam quando os elétrons que vão do cátodo em direção ao ânodo, colidem com os átomos do gás encerrado no tubo de Crookes..

À medida que as partículas do mesmo sinal se repelem, os elétrons que vão em direção ao ânodo arrancam os elétrons presentes na crosta dos átomos de gás..
Assim, os átomos que permaneceram carregados positivamente - ou seja, foram transformados em íons positivos (cátions) - são atraídos para o cátodo (carregados negativamente).
Índice do artigo
- 1 descoberta
- 2 propriedades
- 3 Um pouco de história
- 3.1 O tubo de raios anódicos
- 3.2 O próton
- 3,3 espectrometria de massa
- 4 referências
Descoberta
Foi o físico alemão Eugen Goldstein quem os descobriu, observando-os pela primeira vez em 1886.
Posteriormente, o trabalho realizado em raios anódicos pelos cientistas Wilhelm Wien e Joseph John Thomson acabou assumindo o desenvolvimento da espectrometria de massa..
Propriedades
As principais propriedades dos raios anódicos são as seguintes:
- Eles têm uma carga positiva, o valor de sua carga sendo um múltiplo inteiro da carga do elétron (1,6 ∙ 10-19 C).
- Eles se movem em linha reta na ausência de campos elétricos e campos magnéticos.
- Eles se desviam na presença de campos elétricos e campos magnéticos, movendo-se em direção à zona negativa.
- Pode penetrar em finas camadas de metais.
- Eles podem ionizar gases.
- Tanto a massa quanto a carga das partículas que constituem os raios anódicos variam dependendo do gás encerrado no tubo. Normalmente, sua massa é idêntica à massa dos átomos ou moléculas dos quais são derivados..
- Eles podem causar mudanças físicas e químicas.
Um pouco de história
Antes da descoberta dos raios anódicos, ocorreu a descoberta dos raios catódicos, que ocorreu ao longo dos anos de 1858 e 1859. A descoberta se deve a Julius Plücker, matemático e físico de origem alemã..
Mais tarde, foi o físico inglês Joseph John Thomson quem estudou em profundidade o comportamento, as características e os efeitos dos raios catódicos..
Por sua vez, Eugen Goldstein - que já havia feito outras investigações com os raios catódicos - foi quem descobriu os raios anódicos. A descoberta ocorreu em 1886 e ele a fez quando percebeu que os tubos de descarga com o cátodo perfurado também emitiam luz na extremidade do cátodo..
Descobriu assim que, além dos raios catódicos, havia outros raios: raios anódicos; estes estavam se movendo na direção oposta. Como esses raios passavam pelos orifícios ou canais do cátodo, ele decidiu chamá-los de raios-canal..
No entanto, não foi ele, mas Wilhelm Wien que mais tarde fez extensos estudos sobre os raios anódicos. Wien, junto com Joseph John Thomson, acabou estabelecendo as bases para espectrometria de massa.
A descoberta de Eugen Goldstein sobre os raios anódicos constituiu um pilar fundamental para o desenvolvimento posterior da física contemporânea..
Graças à descoberta dos raios anódicos, enxames de átomos em movimento rápido e ordenado tornaram-se disponíveis pela primeira vez, cuja aplicação era muito fértil para diferentes ramos da física atômica..
O tubo de raios anódicos
Na descoberta dos raios anódicos, Goldstein usou um tubo de descarga que tinha o catodo perfurado. O processo detalhado pelo qual os raios anódicos são formados em um tubo de descarga de gás é o seguinte.
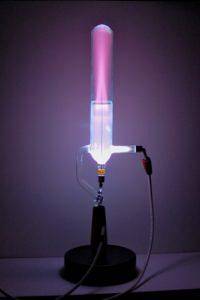
Ao aplicar uma grande diferença de potencial de vários milhares de volts ao tubo, o campo elétrico criado acelera o pequeno número de íons que estão sempre presentes em um gás e que são criados por processos naturais como a radioatividade..
Esses íons acelerados colidem com átomos do gás, arrancando elétrons deles e criando mais íons positivos. Por sua vez, esses íons e elétrons atacam mais átomos novamente, criando mais íons positivos no que é uma reação em cadeia..
Os íons positivos são atraídos para o cátodo negativo e alguns passam por orifícios no cátodo. No momento em que alcançam o cátodo, eles já se aceleraram rápido o suficiente para que, ao colidirem com outros átomos e moléculas no gás, eles excitem a espécie para níveis de energia mais elevados..
Quando essas espécies retornam aos seus níveis de energia originais, os átomos e moléculas liberam a energia que ganharam anteriormente; a energia é emitida na forma de luz.
Este processo de produção de luz, denominado fluorescência, faz com que apareça um brilho na região onde os íons emergem do cátodo..
O próton
Embora Goldstein tenha obtido prótons com seus experimentos com raios anódicos, a verdade é que ele não é o responsável pela descoberta do próton, já que não foi capaz de identificá-lo corretamente..
O próton é a mais leve das partículas positivas produzidas nos tubos de raios anódicos. O próton é produzido quando o tubo é carregado com gás hidrogênio. Dessa forma, quando o hidrogênio se ioniza e perde seu elétron, obtêm-se prótons..
O próton tem uma massa de 1,67 ∙ 10-24 g, quase igual ao do átomo de hidrogênio, e com a mesma carga, mas com sinal oposto ao do elétron; ou seja, 1,6 ∙ 10-19 C.
Espectrometria de massa
A espectrometria de massa, desenvolvida a partir da descoberta dos raios anódicos, é um procedimento analítico que permite estudar a composição química das moléculas de uma substância com base em sua massa..
Permite reconhecer compostos desconhecidos, contar compostos que são conhecidos, bem como conhecer as propriedades e estrutura das moléculas de uma substância.
Por sua vez, o espectrômetro de massa é um dispositivo com o qual a estrutura de diferentes compostos químicos e isótopos pode ser analisada de forma muito precisa..
O espectrômetro de massa permite a separação de núcleos atômicos com base na relação entre massa e carga.

Referências
-
- Raio anódico (n.d.). Na Wikipedia. Obtido em 19 de abril de 2018, em es.wikipedia.org.
- Raio anódico (n.d.). Na Wikipedia. Obtido em 19 de abril de 2018, em en.wikipedia.org.
- Espectrômetro de massa (n.d.). Na Wikipedia. Obtido em 19 de abril de 2018, em es.wikipedia.org.
- Grayson, Michael A. (2002). Medindo a massa: de raios positivos a proteínas. Filadélfia: Chemical Heritage Press
- Grayson, Michael A. (2002). Medindo a massa: de raios positivos a proteínas. Filadélfia: Chemical Heritage Press.
- Thomson, J. J. (1921). Raios de eletricidade positiva e sua aplicação em análises químicas (1921)
- Fidalgo Sánchez, José Antonio (2005). Física e Química. Everest



Ainda sem comentários