
Quais são as forças dipolo dipolo?
As forças dipolo dipolo ou as forças de Keesom são aquelas interações intermoleculares presentes em moléculas com momentos de dipolo permanentes. É uma das forças de Van der Waals e, embora esteja longe de ser a mais forte, é um fator chave que explica as propriedades físicas de muitos compostos..
O termo "dipolo" refere-se explicitamente a dois pólos: um negativo e um positivo. Assim, falamos de moléculas dipolares quando elas possuem regiões definidas de alta e baixa densidade eletrônica, o que só é possível se os elétrons "migrarem" preferencialmente para determinados átomos: os mais eletronegativos..
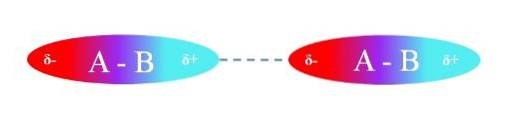
A imagem superior ilustra as interações dipolo-dipolo entre duas moléculas A-B com momentos de dipolo permanentes. Da mesma forma, pode-se observar como as moléculas são orientadas para que as interações sejam eficientes. Assim, a região positiva δ + atrai a região negativa δ-.
De acordo com o exposto, pode ser especificado que esses tipos de interações são direcionais (ao contrário das interações carga-carga iônica). As moléculas em seu ambiente orientam seus pólos de tal forma que, embora sejam fracas, a soma de todas essas interações dá ao composto uma grande estabilidade intermolecular..
Isso resulta em que os compostos (orgânicos ou inorgânicos) capazes de formar interações dipolo-dipolo exibem altos pontos de ebulição ou fusão..
Índice do artigo
- 1 momento dipolo
- 1.1 Simetria
- 1.2 Assimetria em moléculas não lineares
- 2 orientações dos dipolos
- 3 Interações por ligações de hidrogênio
- 4 referências
Momento dipolo
O momento de dipolo µ de uma molécula é uma quantidade vetorial. Em outras palavras: depende das direções onde existe um gradiente de polaridade. Como e por que esse gradiente se origina? A resposta está nas ligações e na natureza intrínseca dos átomos dos elementos..
Por exemplo, na imagem superior A é mais eletronegativo do que B, então na ligação A-B a maior densidade de elétrons está localizada em torno de A.
Por outro lado, B "desiste" de sua nuvem de elétrons e, portanto, é cercado por uma região pobre em elétrons. Esta diferença de eletronegatividades entre A e B cria o gradiente de polaridade.
Como uma região é rica em elétrons (δ-) enquanto a outra é pobre em elétrons (δ +), surgem os dois pólos que, dependendo das distâncias entre eles, originam magnitudes diferentes de µ, que são determinadas para cada composto.
Simetria
Se uma molécula de um determinado composto tem µ = 0, então é considerada uma molécula apolar (mesmo que tenha gradientes de polaridade).
Para entender como a simetria - e, portanto, a geometria molecular - desempenha um papel importante neste parâmetro, é necessário considerar a ligação A-B novamente..
Devido à diferença em suas eletronegatividades, existem regiões definidas ricas e pobres em elétrons..
E se os links fossem A-A ou B-B? Nessas moléculas não haveria momento de dipolo, já que ambos os átomos atraem para si da mesma forma os elétrons da ligação (ligação covalente cem por cento).
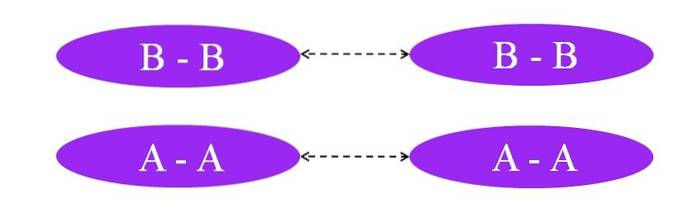
Como pode ser visto na imagem, nem na molécula A-A nem na molécula B-B agora existem regiões ricas ou pobres em elétrons (vermelho e azul). Aqui, outro tipo de força é responsável por manter unida Adois e Bdois: interações dipolo-dipolo induzidas, também conhecidas como forças de Londres ou forças de espalhamento.
Pelo contrário, se as moléculas fossem do tipo AOA ou BOB, haveria repulsões entre seus pólos porque têm cargas iguais:
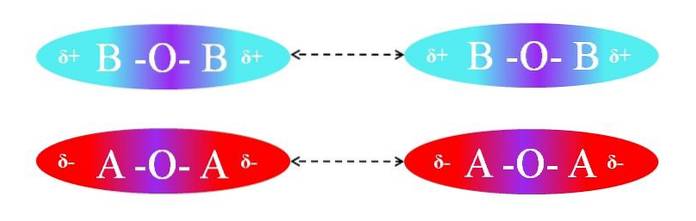
As regiões δ + de duas moléculas BOB não permitem interação dipolo-dipolo eficiente; o mesmo é verdade para as regiões δ- das duas moléculas AOA. Da mesma forma, ambos os pares de moléculas têm µ = 0. O gradiente de polaridade O-A é vetorialmente cancelado com o da ligação A-O.
Consequentemente, as forças de dispersão também entram em jogo no par AOA e BOB, devido à ausência de uma orientação efetiva dos dipolos.
Assimetria em moléculas não lineares
O caso mais simples é o da molécula de CF4 (ou digite CX4) Aqui, C tem uma geometria molecular tetraédrica e regiões ricas em elétrons estão nos vértices, especificamente nos átomos eletronegativos de F.
O gradiente de polaridade C-F se cancela em qualquer uma das direções do tetraedro, fazendo com que a soma vetorial de todos estes seja igual a 0.
Assim, embora o centro do tetraedro seja muito positivo (δ +) e seus vértices muito negativos (δ-), essa molécula não pode formar interações dipolo-dipolo com outras moléculas..
Orientações dos dipolos
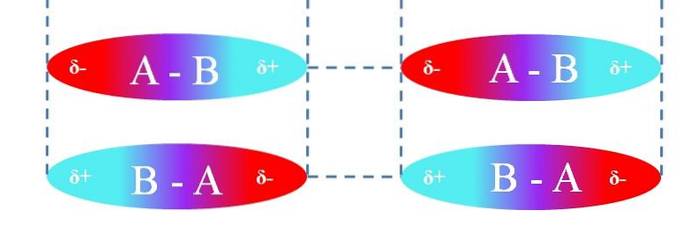
No caso das moléculas A-B lineares, elas são orientadas de tal forma que formam as interações dipolo-dipolo mais eficientes (como pode ser visto na imagem acima). O acima é aplicável da mesma forma para outras geometrias moleculares; por exemplo, os angulares no caso de moléculas de NOdois.
Assim, essas interações determinam se o composto A-B é um gás, um líquido ou um sólido à temperatura ambiente..
No caso dos compostos Adois e Bdois (aquelas das elipses roxas), é muito provável que sejam gasosas. No entanto, se seus átomos forem muito volumosos e facilmente polarizáveis (o que aumenta as forças de London), ambos os compostos podem ser sólidos ou líquidos..
Quanto mais fortes forem as interações dipolo-dipolo, maior será a coesão entre as moléculas; da mesma forma, quanto mais altos são os pontos de fusão e ebulição do composto. Isso ocorre porque temperaturas mais altas são necessárias para "quebrar" essas interações..
Por outro lado, um aumento na temperatura faz com que as moléculas vibrem, girem e se movam com mais frequência. Esta “agitação molecular” prejudica as orientações dos dipolos e, portanto, as forças intermoleculares do composto são enfraquecidas..
Interações de ligação de hidrogênio
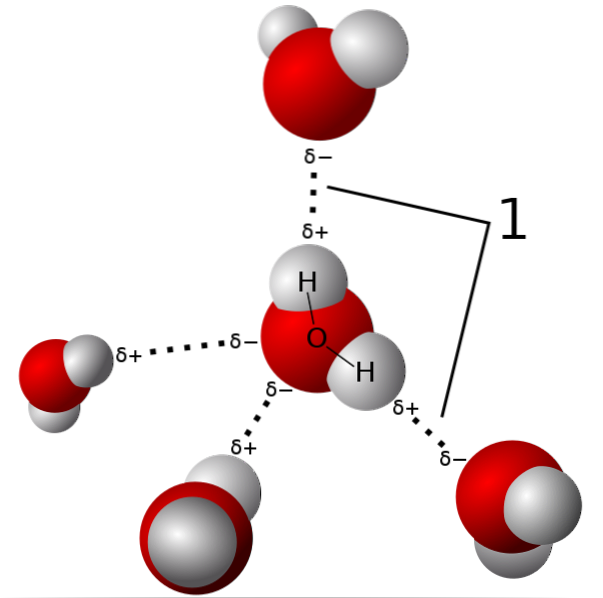
Na imagem acima, cinco moléculas de água são mostradas interagindo por ligações de hidrogênio. Este é um tipo especial de interação dipolo-dipolo. A região pobre em elétrons é ocupada por H; e a região rica em elétrons (δ-) é ocupada pelos átomos altamente eletronegativos N, O e F.
Ou seja, moléculas com átomos de N, O e F ligados a H podem formar ligações de hidrogênio..
Assim, as ligações de hidrogênio são O-H-O, N-H-N e F-H-F, O-H-N, N-H-O, etc. Essas moléculas têm momentos dipolares permanentes e muito intensos, que as orientam corretamente para "aproveitar" essas pontes..
Eles são energeticamente mais fracos do que qualquer ligação covalente ou iônica. Porém, a soma de todas as ligações de hidrogênio na fase de um composto (sólido, líquido ou gasoso) faz com que ele exiba propriedades que o definem como único..
Por exemplo, é o caso da água, cujas ligações de hidrogênio são responsáveis por seu alto ponto de ebulição e por serem menos densas no estado de gelo do que a água líquida; razão pela qual os icebergs flutuam nos mares.
Referências
- Forças dipolo-dipolo. Obtido em 30 de maio de 2018, em: chem.purdue.edu
- Aprendizagem sem limites. Força dipolo-dipolo. Obtido em 30 de maio de 2018, em :ourses.lumenlearning.com
- Jennifer Roushar. (2016). Forças dipolo-dipolo. Recuperado em 30 de maio de 2018, em: sophia.org
- Helmenstine, Anne Marie, Ph.D. (03 de maio de 2018). Quais são os exemplos de ligação de hidrogênio? Obtido em 30 de maio de 2018, em: Thoughtco.com
- Mathews, C. K., Van Holde, K.E. e Ahern, K.G. (2002) Biochemistry. Terceira edição. Addison Wesley Longman, Inc., P 33.
- Whitten, Davis, Peck & Stanley. Química. (8ª ed.). CENGAGE Learning, p 450-452.
- Usuário Qwerter. (16 de abril de 2011). Modelo 3D de ligações de hidrogênio no banheiro. [Figura]. Obtido em 30 de maio de 2018, em: commons.wikimedia.org



Ainda sem comentários