
Conceito e explicação do princípio de Aufbau, exemplos
O Princípio Aufbau Consiste em um guia útil para prever teoricamente a configuração eletrônica de um elemento. Palavra Aufbau refere-se ao verbo alemão "construir". As regras ditadas por este princípio têm como objetivo "ajudar a construir o átomo".
Ao falar da hipotética construção atômica, refere-se exclusivamente aos elétrons, que por sua vez andam de mãos dadas com o aumento do número de prótons. Os prótons definem o número atômico Z de um elemento químico e, para cada um adicionado ao núcleo, um elétron é adicionado para compensar esse aumento de carga positiva..
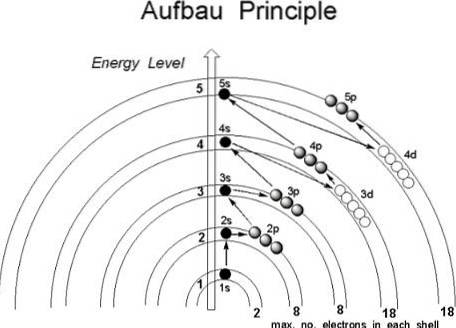
Embora pareça que os prótons não sigam uma ordem estabelecida para se juntar ao núcleo do átomo, os elétrons seguem uma série de condições, de tal forma que ocupam primeiro as regiões do átomo com menor energia, especificamente aquelas onde o probabilidade de encontrá-los no espaço é maior: os orbitais.
O princípio de Aufbau, junto com outras regras de preenchimento eletrônico (o princípio de exclusão de Pauli e regra de Hund), ajuda a estabelecer a ordem em que os elétrons devem ser adicionados à nuvem de elétrons; desta forma, é possível atribuir uma configuração eletrônica adequada de um determinado elemento químico.
Índice do artigo
- 1 Conceito e explicação
- 1.1 Camadas e subcamadas
- 1.2 Princípio de exclusão de Pauli e regra de Hund
- 2 exemplos
- 2.1 Carbono
- 2.2 Oxigênio
- 2.3 Cálcio
- 3 Limitações do princípio Aufbau
- 4 referências
Conceito e explicação
Se o átomo fosse considerado como se fosse uma cebola, um número finito de camadas seria encontrado dentro dele, determinado pelo número quântico principal n.
Além disso, dentro delas, estão as subcamadas, cujas formas dependem dos números quânticos azimutais le magnéticos m.
Os orbitais são identificados pelos três primeiros números quânticos, enquanto o quarto, o spin s, acaba indicando em qual orbital o elétron estará localizado. É então nessas regiões do átomo que os elétrons giram, das camadas mais internas para as mais externas: a camada de valência, a mais energética de todas..
Sendo assim, em que ordem os elétrons devem preencher os orbitais? De acordo com o princípio Aufbau, eles devem ser atribuídos com base no valor crescente (n + l).
Da mesma forma, dentro das sub-camadas (n + l), os elétrons devem ocupar a sub-camada com o menor valor de energia; em outras palavras, eles ocupam o menor valor de n.
Seguindo essas regras de construção, Madelung desenvolveu um método visual que consiste em desenhar setas diagonais, que ajudam a construir a configuração eletrônica de um átomo. Em algumas esferas educacionais, esse método também é conhecido como método da chuva..
Camadas e subcamadas
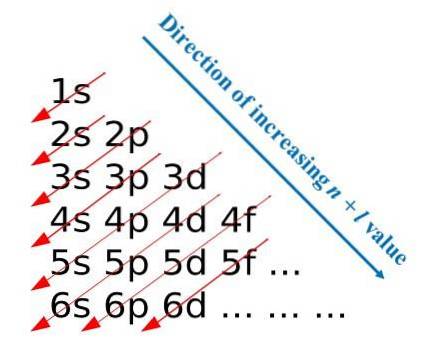
A primeira imagem ilustra um método gráfico para obter as configurações eletrônicas, enquanto a segunda imagem é o respectivo método de Madelung. As camadas mais energéticas estão localizadas no topo e as menos energéticas estão na direção descendente..
Da esquerda para a direita, as subcamadas s, p, d e f de seus níveis de energia principais correspondentes são “transitadas”. Como calcular o valor de (n + l) para cada etapa marcada pelas setas diagonais? Por exemplo, para o orbital 1s este cálculo é igual a (1 + 0 = 1), para o orbital 2s (2 + 0 = 2) e para o orbital 3p (3 + 1 = 4).
O resultado desses cálculos dá origem à construção da imagem. Portanto, se não estiver disponível, basta determinar (n + l) para cada orbital, começando a preencher os orbitais com elétrons daquele com o menor valor de (n + l) até aquele com o valor máximo.
No entanto, o uso do método Madelung facilita muito a construção da configuração do elétron e o torna uma atividade divertida para aqueles que estão aprendendo a tabela periódica..
Princípio de exclusão de Pauli e regra de Hund
O método Madelung não indica os orbitais das subcamadas. Levando-os em consideração, o princípio de exclusão de Pauli afirma que nenhum elétron pode ter os mesmos números quânticos que outro; ou o que é o mesmo, um par de elétrons não pode ter spins positivos ou negativos.
Isso significa que seus números quânticos de spin s não podem ser iguais e, portanto, seus spins devem emparelhar quando ocupam o mesmo orbital.
Por outro lado, o preenchimento dos orbitais deve ser feito de forma que se degenere em energia (regra de Hund). Isso é conseguido mantendo todos os elétrons nos orbitais desemparelhados, até que seja estritamente necessário emparelhar um par deles (como com o oxigênio).
Exemplos
Os exemplos a seguir resumem todo o conceito do princípio Aufbau..
Carbono
Para determinar sua configuração eletrônica, o número atômico Z deve primeiro ser conhecido e, portanto, o número de elétrons. O carbono tem Z = 6, então seus 6 elétrons devem estar localizados nos orbitais usando o método de Madelung:

As setas correspondem aos elétrons. Depois de preencher os orbitais 1s e 2s, cada um com dois elétrons, os orbitais 2p por diferença são atribuídos aos dois elétrons restantes. A regra de Hund é assim manifestada: dois orbitais degenerados e um vazio.
Oxigênio

O oxigênio tem Z = 8, então tem dois elétrons extras, ao contrário do carbono. Um desses elétrons deve ser colocado no orbital 2p vazio, e o outro deve emparelhar para formar o primeiro par, com a seta apontando para baixo. Consequentemente, aqui o princípio de exclusão de Pauli se manifesta.
Cálcio
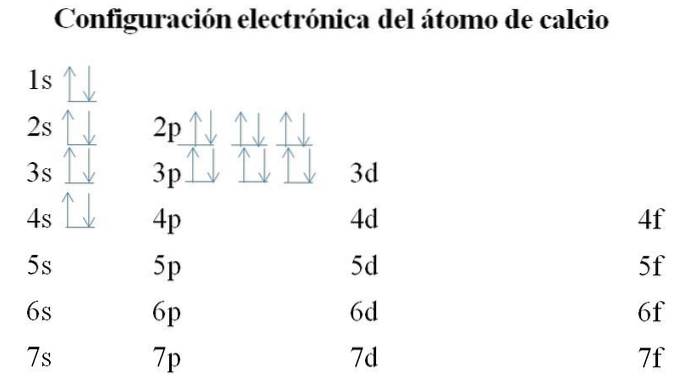
O cálcio tem 20 elétrons e os orbitais ainda são preenchidos com o mesmo método. A ordem de enchimento é a seguinte: 1s-2s-2p-3s-3p-4s.
Pode-se notar que em vez de preencher o orbital 3d primeiro, os elétrons ocupam os 4s. Isso ocorre antes de abrir caminho para metais de transição, elementos que preenchem a camada interna 3d.
Limitações do princípio Aufbau
O princípio de Aufbau falha em prever as configurações eletrônicas de muitos metais de transição e elementos de terras raras (lantanídeos e actinídeos).
Isso ocorre porque as diferenças energéticas entre os orbitais ns e (n-1) d são baixas. Por razões apoiadas pela mecânica quântica, os elétrons podem preferir degenerar os orbitais (n-1) d ao custo de desfazer ou desalojar elétrons do orbital ns.
Um exemplo famoso é o caso do cobre. Sua configuração eletrônica prevista pelo princípio de Aufbau é 1sdois2sdois2 P63sdois3p64sdois3d9, quando experimentalmente foi mostrado ser 1sdois2sdois2 P63sdois3p64s13d10.
No primeiro, um elétron solitário está desemparelhado em um orbital 3d, enquanto no segundo, todos os elétrons nos orbitais 3d estão emparelhados..
Referências
- Helmenstine, Anne Marie, Ph.D. (15 de junho de 2017). Definição do princípio de Aufbau. Retirado de: Thoughtco.com
- Prof. N. De Leon. (2001). O Princípio Aufbau. Retirado de: iun.edu
- Química 301. Princípio de Aufbau. Retirado de: ch301.cm.utexas.edu
- Hozefa Arsiwala e teacherlookup.com. (1 ° de junho de 2017). Em profundidade: Princípio de Aufbau com exemplos. Retirado de: teacherlookup.com
- Whitten, Davis, Peck & Stanley. Química. (8ª ed.). CENGAGE Learning, p 199-203.
- Goodphy. (27 de julho de 2016). Esquema de Madelung. [Figura]. Retirado de: commons.wikimedia.org



Ainda sem comentários