
Estrutura e função da célula seca
UMA pilha seca é uma bateria cujo meio eletrolítico consiste em uma pasta e não em uma solução. A referida pasta, no entanto, apresenta um certo nível de umidade e, por isso, não é estritamente seca..
A pouca quantidade de água é suficiente para os íons se moverem e, consequentemente, o fluxo de elétrons dentro da célula..

Sua enorme vantagem sobre as primeiras baterias úmidas é que, como se trata de uma pasta eletrolítica, seu conteúdo não pode ser derramado; o que acontecia com as baterias úmidas, que eram mais perigosas e delicadas do que as baterias secas. Dada a impossibilidade de derramamentos, a célula seca encontra uso em muitos dispositivos portáteis e móveis.
Na imagem acima, há uma bateria seca de zinco-carbono. Mais exatamente, é uma versão moderna da pilha de Georges Leclanché. De tudo, é o mais comum e talvez o mais simples.
Esses dispositivos representam uma comodidade energética pelo fato de possuírem energia química na bolsa que pode ser transformada em eletricidade; e, desta forma, não depender de tomadas ou da energia fornecida por grandes usinas e sua vasta rede de torres e cabos.
Índice do artigo
- 1 Estrutura da célula seca
- 1.1 Eletrodos
- 1.2 Terminais
- 1.3 Areia e cera
- 2 Operação
- 2.1 Oxidação do eletrodo de zinco
- 2.2 Redução de cloreto de amônio
- 2.3 Download
- 3 referências
Estrutura de célula seca
Qual é a estrutura de uma célula seca? Na imagem você pode ver sua capa, que nada mais é do que um filme polimérico, aço e os dois terminais cujas arruelas isolantes se projetam da frente.
No entanto, esta é apenas sua aparência externa; suas partes mais importantes estão dentro, o que garante seu bom funcionamento.
Cada célula seca terá suas próprias características, mas apenas a célula de zinco-carbono será considerada, da qual uma estrutura geral para todas as outras baterias pode ser delineada..
Entende-se por bateria a união de duas ou mais baterias, sendo estas células voltaicas, conforme será explicado em seção futura..
Eletrodos
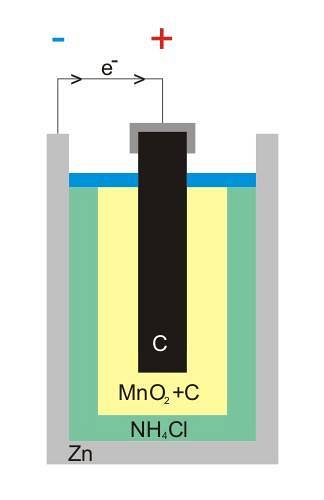
A imagem superior mostra a estrutura interna de uma bateria de zinco-carbono. Não importa o que seja a célula voltaica, deve sempre (geralmente) haver dois eletrodos: um do qual os elétrons são emitidos e outro que os recebe..
Os eletrodos são materiais eletricamente condutores e, para que haja corrente, ambos devem ter eletronegatividades diferentes.
Por exemplo, o zinco, uma lata branca que envolve a bateria, é de onde os elétrons saem para o circuito elétrico (dispositivo) onde é conectado.
Por outro lado, em todo o meio está o eletrodo de carbono grafítico; também imerso em uma pasta composta de NH4Cl, ZnCldois e MnOdois.
Este eletrodo é aquele que recebe os elétrons, e note que ele possui o símbolo '+', o que significa que é o terminal positivo da bateria.
Terminais
Como visto acima da haste de grafite na imagem, existe o terminal elétrico positivo; e abaixo, o zinco interno pode de onde fluem os elétrons, o terminal negativo.
É por isso que as baterias têm marcas '+' ou '-' para indicar a maneira correta de conectá-las ao dispositivo e, assim, permitir que ele ligue..
Areia e cera
Embora não mostrada, a pasta é protegida por uma areia tampão e um lacre de cera que evita que ela respingue ou entre em contato com o aço sob pequenos impactos mecânicos ou agitação..
Funcionamento
Como funciona uma célula seca? Para começar, é uma célula voltaica, ou seja, gera eletricidade a partir de reações químicas. Portanto, dentro das células ocorrem reações redox, onde as espécies ganham ou perdem elétrons..
Os eletrodos servem como superfície que facilita e permite o desenvolvimento dessas reações. Dependendo de suas cargas, pode ocorrer oxidação ou redução das espécies.
Para melhor entender isso, apenas os aspectos químicos da bateria de zinco-carbono serão explicados..
Oxidação de eletrodo de zinco
Assim que o dispositivo eletrônico for ligado, a bateria irá liberar elétrons oxidando o eletrodo de zinco. Isso pode ser representado pela seguinte equação química:
Zn => Zndois+ + 2e--
Se houver muito Zndois+ envolvendo o metal, ocorrerá uma polarização de carga positiva, de modo que não haverá mais oxidação. Portanto, o Zndois+ deve se difundir através da pasta em direção ao cátodo, onde os elétrons entrarão de volta.
Assim que os elétrons ativam o artefato, eles voltam para o outro eletrodo: o de grafite, para encontrar algumas espécies químicas "esperando" por ele..
Redução de cloreto de amônio
Como afirmado anteriormente, há NH nas massas4Cl e MnOdois, substâncias que tornam seu pH ácido. Assim que os elétrons entram, as seguintes reações ocorrerão:
2NH4+ + 2e- => 2NH3 + Hdois
Os dois produtos, amônia e hidrogênio molecular, NH3 e Hdois, são gases e, portanto, podem "inchar" a bateria se não sofrerem outras transformações; como os dois seguintes:
Zndois+ + 4NH3 => [Zn (NH3)4]dois+
Hdois + 2MnOdois => 2MnO (OH)
Observe que o amônio foi reduzido (ganhou elétrons) para se tornar NH3. Esses gases foram então neutralizados pelos outros componentes da pasta..
O complexo [Zn (NH3)4]dois+ facilita a difusão de íons Zndois+ em direção ao cátodo e, assim, evitar que a bateria "pare".
O circuito externo do artefato funciona como uma ponte para os elétrons; caso contrário, nunca haveria uma conexão direta entre a lata de zinco e o eletrodo de grafite. Na imagem da estrutura, este circuito representaria o cabo preto.
Download
As células secas vêm em muitas variantes, tamanhos e tensões de trabalho. Alguns deles não são recarregáveis (células voltaicas primárias), enquanto outros são (células voltaicas secundárias).
A bateria de zinco-carbono tem uma tensão de trabalho de 1,5V. Suas formas mudam com base em seus eletrodos e na composição de seus eletrólitos..
Chegará um ponto em que todo o eletrólito terá reagido, e por mais que o zinco seja oxidado, não haverá espécie que receba os elétrons e promovam sua liberação..
Além disso, pode ser o caso em que os gases formados deixem de ser neutralizados e permaneçam exercendo pressão no interior das baterias..
As baterias de zinco-carbono e outras baterias que não são recarregáveis devem ser recicladas; já que seus componentes, principalmente componentes de níquel-cádmio, são prejudiciais ao meio ambiente por poluir solos e águas.
Referências
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Química. (8ª ed.). CENGAGE Learning.
- A bateria "célula seca". Recuperado de: makahiki.kcc.hawaii.edu
- Hoffman S. (10 de dezembro de 2014). O que é uma bateria de célula seca? Recuperado de: upsbatterycenter.com
- Weed, Geoffrey. (24 de abril de 2017). Como funcionam as baterias de célula seca? Ciência. Recuperado de: sciencing.com
- Woodford, Chris. (2016) Baterias. Recuperado de: explainthatstuff.com.



Ainda sem comentários