
Estrutura, propriedades, usos, riscos do nitrobenzeno (C6H5NO2)
O nitrobenzeno é um composto orgânico aromático formado por um anel de benzeno C6H5- e um grupo nitro-NOdois. Sua fórmula química é C6H5NÃOdois. É um líquido oleoso incolor ou amarelo claro, com cheiro de amêndoas amargas ou graxa de sapato..
O nitrobenzeno é um composto de grande utilidade na indústria química, pois permite a obtenção de uma série de substâncias químicas com diversos usos. Isso porque pode estar sujeito a vários tipos de reações.
Reações químicas importantes incluem nitração (que permite que mais grupos -NO sejam adicionadosdois à molécula) e redução (o oposto da oxidação, uma vez que os dois átomos de oxigênio do grupo nitro-NO são eliminadosdois e são substituídos por hidrogênios).
Com nitrobenzeno, por exemplo, anilina e para-acetaminofenol podem ser preparados. Este último é o conhecido acetaminofeno, que é um antipirético (medicamento contra a febre) e analgésico leve (medicamento contra dores leves)..
O nitrobenzeno deve ser manuseado com cautela, pois é irritante e tóxico, pode causar um tipo de anemia, entre vários sintomas, e acredita-se que cause câncer. Também é prejudicial ao meio ambiente.
Índice do artigo
- 1 Estrutura
- 2 Nomenclatura
- 3 propriedades
- 3.1 Estado físico
- 3.2 Peso molecular
- 3.3 Ponto de fusão
- 3.4 Ponto de ebulição
- 3,5 ponto de fulgor
- 3.6 Temperatura de autoignição
- 3.7 Densidade
- 3.8 Solubilidade
- 3.9 Propriedades químicas
- 3.10 Formação de dímero
- 3.11 Outras propriedades
- 4 Obtendo
- 5 usos
- 5.1 Na obtenção de anilina e paracetamol
- 5.2 Na obtenção de outros compostos químicos
- 5.3 Em várias aplicações
- 6 riscos
- 7 Tratamentos para sua eliminação do meio ambiente
- 8 referências
Estrutura
Nitrobenzeno C6H5-NÃOdois é uma molécula plana formada por um anel de benzeno C6H5- ao qual um grupo nitro-NO é anexadodois. Sua molécula é plana porque há uma interação eletrônica entre o grupo nitro-NOdois e o anel de benzeno.
O grupo nitro -NOdois tende a atrair elétrons do anel benzênico C6H5-.
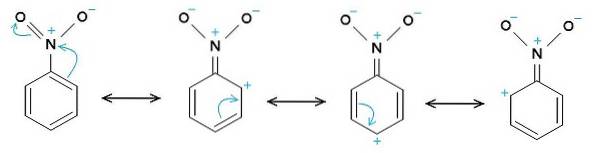
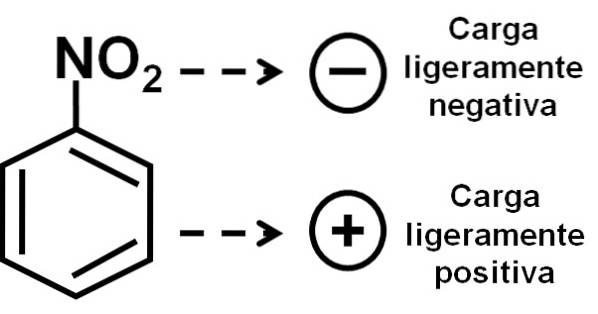
Portanto, a molécula tem um lado ligeiramente mais negativo (onde os oxigênios de -NOdois) e um lado ligeiramente mais positivo (o anel de benzeno).
Nomenclatura
- Nitrobenzeno.
- Nitrobenzina.
- Nitrobenzol.
- Myrban ou óleo ou essência de myrban (termo fora de uso).
Propriedades
Estado físico
Líquido oleoso incolor a amarelo pálido.
Peso molecular
123,11 g / mol.
Ponto de fusão
5,7 ºC.
Ponto de ebulição
211 ºC.
Ponto de inflamação
88 ºC (método de copo fechado).
Temperatura de autoignição
480 ° C.
Densidade
1,2037 g / cm3 a 20 ºC.
Solubilidade
Ligeiramente solúvel em água: 0,19 g / 100 g de água a 20 ° C. Totalmente miscível com álcool, benzeno e éter dietílico.
Propriedades quimicas
O nitrobenzeno é estável até aproximadamente 450 ° C de temperatura na qual começa a se decompor formando (na ausência de oxigênio) NO, NOdois, benzeno, bifenil, anilina, dibenzofurano e naftaleno.
Reações importantes do nitrobenzeno incluem redução, nitração, halogenação e sulfonação..
A nitração do nitrobenzeno produz inicialmente metanitrobenzeno e com um tempo de reação prolongado é obtido 1,3,5-nitrobenzeno.
Ao reagir bromo ou cloro com nitrobenzeno na presença de um catalisador apropriado, é obtido 3-bromo-nitrobenzeno (meta-bromonitrobenzeno) ou 3-cloro-nitrobenzeno (meta-cloronitrobenzeno)..
Um exemplo de redução é que ao tratar com estanho (Sn) em ácido clorídrico (HCl) os meta-halogenonitrobenzenos são obtidos as meta-halogenoanilinas.
A sulfonação de nitrobenzeno é realizada com ácido sulfúrico fumante a 70-80 ° C e o produto é ácido meta-nitrobenzenossulfônico. Isso pode ser reduzido com ferro e HCl para dar ácido metanílico..
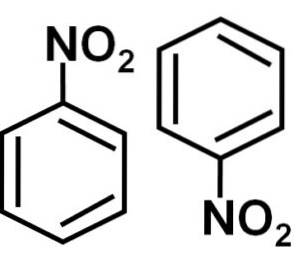
Formação de dímero
Em uma solução de benzeno C6H6 as moléculas de nitrobenzeno se associam entre si para formar dímeros ou pares de moléculas. Nesses pares, uma das moléculas está em posição invertida em relação à outra..
A formação de dímeros de nitrobenzeno com moléculas uma em posição invertida em relação à outra deve-se possivelmente a cada uma delas ter um lado ligeiramente mais carregado positivamente e um lado oposto com uma carga ligeiramente mais negativa..
No dímero, o lado com carga ligeiramente mais positiva de uma das moléculas possivelmente está localizado próximo à carga levemente negativa da outra molécula, uma vez que as cargas opostas se atraem, e é o caso dos outros dois lados..
Outras propriedades
Tem um odor semelhante a amêndoas ou graxa de sapato. Ao baixar sua temperatura, ele se solidifica na forma de cristais amarelo-esverdeados.
Obtendo
Obtido pelo tratamento de benzeno C6H6 com uma mistura de ácido nítrico HNO3 e ácido sulfúrico HdoisSW4. O processo é denominado nitração e envolve a formação do íon nitrônio NOdois+ graças à presença de ácido sulfúrico HdoisSW4.
- Formação de NO de íon nitrôniodois+:
HNO3 + 2 hdoisSW4 ⇔ H3OU+ + 2 HSO4- + NÃOdois+ (íon nitrônio)
- O íon nitrônio ataca o benzeno:
C6H6 + NÃOdois+ → C6H6NÃOdois+
- O nitrobenzeno é formado:
C6H6NÃOdois+ + HSO4- → C6H5NÃOdois + HdoisSW4
Em resumo:
C6H6 + HNO3 → C6H5NÃOdois + HdoisOU
A reação de nitração do benzeno é muito exotérmica, ou seja, muito calor é gerado, por isso é muito perigoso.
Formulários
Na obtenção de anilina e paracetamol
O nitrobenzeno é usado principalmente para sintetizar a anilina C6H5NHdois, que é um composto amplamente utilizado para a preparação de pesticidas, gomas, tinturas, explosivos e medicamentos.
A obtenção da anilina ocorre reduzindo o nitrobenzeno em meio ácido na presença de ferro ou estanho, o que é realizado de acordo com as seguintes etapas:
Nitrobenzeno → Nitrosobenzeno → Fenilhidroxilamina → Anilina
C6H5NÃOdois → C6H5NÃO → C6H5NHOH → C6H5NHdois

Dependendo das condições, o processo pode ser interrompido em uma das etapas intermediárias, por exemplo, fenil-hidroxilamina. A partir de fenilidroxilamina em um meio fortemente ácido, o para-aminofenol pode ser preparado:
Fenilhidroxilamina → p-Aminofenol
C6H5NHOH → HOC6H4NHdois
Este último é tratado com anidrido acético para obter paracetamol (paracetamol), um conhecido antipirético e analgésico leve, ou seja, um medicamento para tratar febre e dor..
Outra forma de obter anilina é reduzindo o nitrobenzeno com monóxido de carbono (CO) em meio aquoso na presença de partículas muito pequenas (nanopartículas) de paládio (Pd) como catalisador..
C6H5-NÃOdois + 3 CO + HdoisO → C6H5-NHdois + 3 COdois
Na obtenção de outros compostos químicos
O nitrobenzeno é o ponto de partida para a obtenção de uma grande variedade de compostos utilizados como corantes, pesticidas, medicamentos e cosméticos.

Por exemplo, permite a obtenção do 1,3-dinitrobenzeno, que por cloração (adição de cloro) e redução (eliminação dos átomos de oxigênio) gera a 3-cloroanilina. É usado como intermediário para pesticidas, corantes e medicamentos.
O nitrobenzeno foi usado para preparar a benzidina, que é um corante. Além disso, o nitrobenzeno é usado para preparar quinolina, azobenzeno, ácido metanílico, dinitrobenzeno, isocianatos ou piroxilina entre muitos outros compostos..
Em várias aplicações
O nitrobenzeno é usado ou tem sido usado como:
- Solvente de extração para purificação de óleos lubrificantes usados em máquinas
- Solvente para éteres de celulose
- Ingrediente de mistura de polimento de metal
- Em sabonetes
- Em misturas de polimento de calçados
- Conservante de tinta spray
- Componente de misturas de polimento de piso
- Substituto de essência de amêndoa
- Na industria de perfumes
- Na produção de borracha sintética
- Solvente em vários processos

Riscos
O nitrobenzeno é tóxico por inalação, ingestão e absorção pela pele..
Irritante para a pele, olhos e trato respiratório. Pode causar um tipo de anemia chamada metemoglobinemia, que envolve uma redução na capacidade dos glóbulos vermelhos de liberar oxigênio para os tecidos e leva à fadiga..
Além disso, o nitrobenzeno causa dispnéia, tontura, visão prejudicada, falta de ar, colapso e morte. Também danifica o fígado, baço, rins e sistema nervoso central.
Estima-se que pode ser mutagênico e possivelmente causador de câncer em humanos, uma vez que o causou em animais.
Além disso, o nitrobenzeno não deve ser eliminado no meio ambiente. Sua toxicidade para animais, plantas e microrganismos o torna muito prejudicial aos ecossistemas.
Toxicidade para microrganismos reduz sua biodegradabilidade.
Tratamentos para sua eliminação do meio ambiente
A contaminação do meio ambiente com nitrobenzeno pode ocorrer por meio de resíduos das diversas indústrias que o utilizam, como a indústria de corantes ou explosivos..
O nitrobenzeno é um poluente altamente tóxico e difícil de se decompor em condições naturais, por isso pode causar grave contaminação da água potável e dos sistemas de irrigação das lavouras..
Devido à sua alta estabilidade e toxicidade para microrganismos, é frequentemente selecionado como modelo em estudos de tratamento de esgoto..
Várias maneiras de remover o nitrobenzeno da água contaminada estão sendo investigadas. Uma delas é por meio da degradação fotocatalítica, ou seja, usando a luz solar como acelerador da reação de degradação na presença de dióxido de titânio TiO.dois.

Métodos de microeletrólise com catalisador de ferro (Fe) e cobre (Cu) em cerâmica também foram testados com sucesso. A microeletrólise permite que o nitrobenzeno seja decomposto por uma corrente elétrica.
Referências
- NÓS. Biblioteca Nacional de Medicina. (2019). Nitrobenzeno. Recuperado de pubchem.ncbi.nlm.nih.gov.
- Morrison, R.T. e Boyd, R.N. (2002). Química orgânica. 6ª Edição. Prentice-Hall.
- Moldoveanu, S.C. (2019). Pirólise de outros compostos que contêm nitrogênio. Em Pyrolysis of Organic Molecules (Segunda Edição). Recuperado de sciencedirect.com.
- Smith, P.W.G. et al. (1969). Compostos Nitro-nitro aromáticos. Substituições eletrofílicas. In Aromatic Chemistry. Recuperado de sciencedirect.com.
- Windholz, M. et al. (editores) (1983). The Merck Index. An Encyclopedia of Chemicals, Drugs and Biologicals. Décima edição. Merck & CO., Inc.
- Enciclopédia de Química Industrial de Ullmann. (1990). Quinta edição. Volume A22. VCH Verlagsgesellschaft mbH.
- Whang, T.-J. et al. (2012). Degradação fotocatalítica irradiada por UV de nitrobenzeno por ligação de titânia em tubo de quartzo. International Journal of Photoenergy, Volume 2012, Article ID 681941. Recuperado de hindawi.com.
- Shikata, T. et al. (2014). Formação de dímero antiparalelo de nitrobenzeno em solventes apolares. AIP Advances 4, 067130 (2014). Recuperado de doaj.org.
- Krogul-Sobczak, A. et al. (2019). Redução de nitrobenzeno a anilina por CO / HdoisO na presença de nanopartículas de paládio. Catalysts 2019, 9, 404. Recuperado de mdpi.com.
- Yang, B. et al. (2019). Produção em escala piloto, propriedades e aplicação de catalisador de enchimento cerâmico de Fe / Cu para tratamento de águas residuais com compostos de nitrobenzeno. Catalysts 2019, 9, 11. Recuperado de mdpi.com.



Ainda sem comentários