
Base, preparação e usos médios de MIO
O meio MIO é um teste bioquímico utilizado para auxiliar na identificação de espécies de bactérias pertencentes à família Enterobacteriaceae. É bastante nutritivo e é composto por glicose, extrato de levedura, peptona, tripteína, cloridrato de L-ornitina, roxo de bromocresol e ágar.
O significado de sua sigla (MIO) descreve cada um dos parâmetros que podem ser observados neste meio; motilidade, indol e ornitina. Motilidade é a capacidade do microrganismo de se mover devido à presença de flagelos. Para que essa propriedade seja observada, a consistência do meio deve ser semissólida, para que a preparação contenha menos ágar..
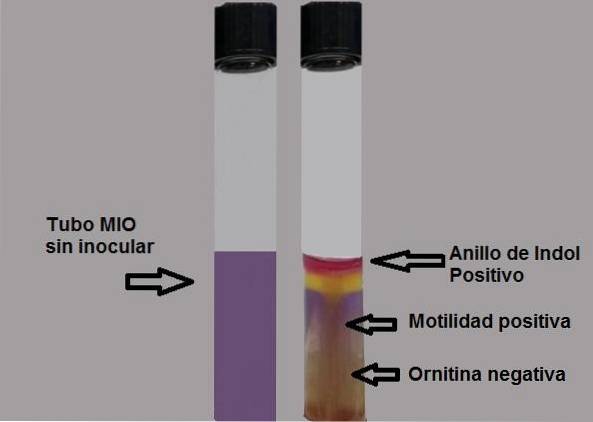
A produção do indol mostra a presença da enzima triptofanase que atua no aminoácido triptofano, sendo necessária a utilização de um reagente revelador para tornar visível a produção do indol..
Por fim, a ornitina determina se a bactéria é capaz de descarboxilar o aminoácido, ou seja, se possui a enzima orinitina descarboxilase.
Índice do artigo
- 1 justificativa
- 1.1 Peptona, extrato de levedura e tripteína
- 1.2 Motilidade
- 1.3 Glicose
- 1,4 L-Ornitina
- 1,5 indicador de pH
- 2 Semeando e desenvolvendo técnica
- 3 Preparação
- 3.1 MIO médio
- 3.2 Reagente Kovacs (Desenvolvedor de Teste Indol)
- 4 Use
- 5 Controle de qualidade
- 6 referências
Base
Peptona, extrato de levedura e tripteína
Esses elementos contribuem para o poder nutricional desse meio. Eles servem como fonte de nutrientes e aminoácidos essenciais para o desenvolvimento bacteriano.
Além disso, a tripteína é uma fonte de triptofano para demonstrar a presença da enzima triptofanase, que degrada o triptofano por desaminação redutiva, liberando indol, ácido pirúvico, amônia e energia..
O indol é incolor, portanto sua presença é revelada pela adição de cinco gotas do reagente de Ehrlich ou Kovacs, ambos com p-dimetilaminobenzaldeído..
O grupo aldeído desse composto reage com o indol, gerando um produto vermelho fúcsia em forma de anel na superfície do ágar..
Qualquer vestígio de cor deve ser considerado um teste positivo. A prova deve ser lida imediatamente, pois com o tempo a cor se degrada.
Além disso, este teste deve ser revelado após os resultados de motilidade e descarboxilação da ornitina terem sido observados..
Interpretação
Teste positivo: formação de um anel vermelho-fúcsia ao adicionar gotas do reagente de Kovacs.
Teste negativo: sem formação de anel.
Motilidade
A capacidade de movimentação da bactéria será evidenciada se for observado um meio turvo ou se houver uma linha de crescimento espessa se expandindo ao redor da inoculação inicial..
Um teste de motilidade negativo será evidenciado pela observação de uma linha tênue de crescimento, e tudo ao seu redor ficará sem crescimento..
É importante que a motilidade seja lida antes que o indol seja revelado, pois a adição do reagente turva todo o meio..
Em bactérias móveis, mas de crescimento lento, é difícil demonstrar sua motilidade com este meio. Neste caso, recomenda-se a utilização de outros testes ou métodos, como a motilidade média ou o método pendente de queda..
Glicose
A glicose é o carboidrato fermentável que, além de fornecer energia, acidifica o meio ambiente, condição necessária para que ocorra a descarboxilação do aminoácido ornitina..
A fermentação da glicose deve ocorrer sempre, partindo do princípio de que todas as bactérias pertencentes à família Enterobacteriaceae fermentam a glicose..
L-Ornitina
No caso de a bactéria produzir a enzima ornitina descarboxilase, esta pode atuar uma vez que o meio tenha sido acidificado pela fermentação da glicose..
A enzima ornitina descarboxilase atua no grupo carboxila do aminoácido produzindo uma amina chamada putresina que alcaliniza o meio novamente.
Este teste deve ser lido após 24 horas de incubação, porque se você tentar ler antes, poderá interpretar erroneamente o teste com um falso negativo.
É preciso lembrar que a primeira reação que ocorre é a fermentação da glicose, razão pela qual o meio fica amarelo na fase inicial (primeiras 10 a 12 horas). Se a descarboxilação da ornitina ocorrer subsequentemente, o meio ficará roxo.
É importante interpretar o teste de descarboxilação da ornitina antes de revelar o indol, pois a adição do reagente de Kovacs modifica a cor do meio..
Interpretação
Teste negativo: meio amarelo ou fundo amarelo.
Teste positivo: meio completamente roxo.
Indicador de pH
Nesse caso, é usado o roxo de bromocresol; o encarregado de revelar quando há alteração do pH do meio. Quando acidificado, o indicador fica amarelo e quando alcalinizado fica roxo.
Semeando e desenvolvendo técnica
Para semear o meio MIO, usa-se uma alça reta ou agulha e com ela é coletada uma porção da colônia a ser estudada..
Uma punção profunda é feita no meio da MIO em uma linha reta. Não é aconselhável a punção dupla, pois pode dar uma falsa imagem de motilidade se as punções não forem realizadas no mesmo local.
Incubar por 24 a 48 horas a 37 ° C em aerobiose. Observe os resultados nesta ordem: motilidade, descarboxilação da ornitina e finalmente revelar o indol.
É aconselhável retirar assepticamente 2 ml do meio, transferi-lo para um tubo estéril e aí realizar o teste de indol, para que se for negativo, o restante do tubo original possa ser incubado por mais 24 horas, para revelar o indole novamente..
O desenvolvimento do indol é realizado da seguinte forma: 3 a 5 gotas do reagente de Kovacs são adicionadas ao meio MIO e é agitado vigorosamente. É observado se um anel vermelho fúcsia aparece ou não.
Preparação
MIO médio
Pesar 31 g do meio MIO e dissolver em um litro de água destilada..
Aquecer até a mistura ferver por um minuto, agitando freqüentemente até que o ágar esteja completamente dissolvido. Distribua 4 ml do meio em tubos de ensaio 13/100 com tampas de algodão.
Esterilize em autoclave a 121 ° C por 15 minutos. Retire da autoclave e deixe descansar em linha reta em um rack, de forma que um bloco semissólido seja formado.
Conservar no refrigerador 2-8 ° C. Deixe aquecer antes de semear a cepa bacteriana.
A cor do meio desidratado é bege e a do meio preparado é ligeiramente púrpura opalescente..
O pH final do meio preparado é 6,5 ± 0,2
O meio fica amarelo em pH ácido e roxo em pH alcalino.
Reagente de Kovacs (desenvolvedor de teste de indol)
Este reagente é preparado da seguinte forma:
150 ml de álcool amílico, isoamílico ou butílico (qualquer um dos três) são medidos. 10 g de p-dimetilaminobenzaldeído são dissolvidos nele. Posteriormente, 50 ml de ácido clorídrico concentrado são adicionados lentamente..
O reagente preparado é incolor ou amarelo claro. Deve ser conservado em frasco âmbar e conservado no refrigerador. Uma cor marrom escura mostra sua deterioração.
Além disso, o reagente de Kovacs pode ser substituído pelo reagente de Ehrlich. Este último, sendo mais sensível, é preferível para revelar indol em bactérias que o produzem em quantidades mínimas, como em alguns bastonetes Gram negativos não fermentadores e certos anaeróbios..
Usar
Este meio é um teste que complementa uma bateria de testes bioquímicos para identificação de bactérias pertencentes à família Enterobacteriaceae..
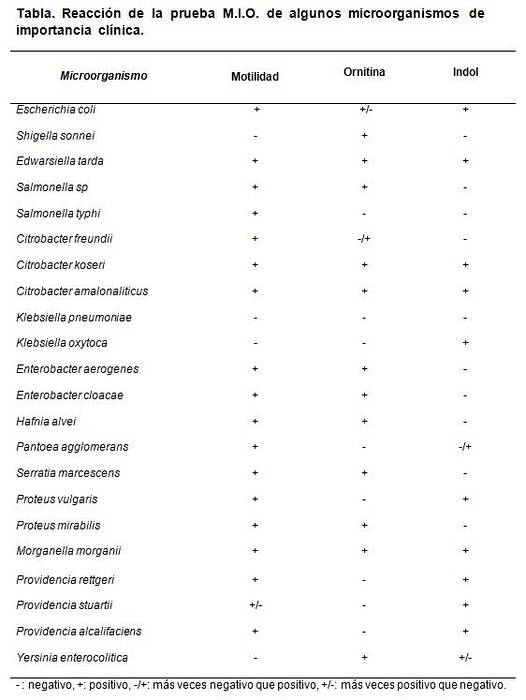
Os dados da descarboxilação da ornitina servem para diferenciar entre Shigella Sonnei, que dá positivo, de Shigella boydii, Shigella flexneri e S. dysenterieae, que dão negativos.
Também diferencia o gênero Klebsiella, cujo teste é negativo, do gênero Enterobacter, onde a maioria de suas espécies apresenta resultado positivo..
Controle de qualidade
Cada vez que um lote de meio MIO é preparado, um teste de controle pode ser realizado. Para isso, cepas conhecidas ou certificadas são utilizadas para observar o comportamento do meio..
As cepas que podem ser usadas são Escherichia coli, Morganella morganii, Klebsiella pneumoniae, Enterobacter aerogenes Y Proteus mirabilis.
Os resultados esperados são E. coli e M. morganii. Dan M: +, I: + e O: +.
Klebsiella pneumoniae dá todos negativos (M: -, I: -, O :-). Proteus mirabilis Y Enterobacter aerogenes dê M: + I: - e O: +.
Referências
- Mac Faddin J. (2003). Testes bioquímicos para identificação de bactérias de importância clínica. 3ª ed. Editorial Panamericana. Bons ares. Argentina.
- Forbes B, Sahm D, Weissfeld A. (2009). Bailey & Scott Microbiological Diagnosis. 12 ed. Editorial Panamericana S.A. Argentina.
- Koneman E, Allen S, Janda W., Schreckenberger P, Winn W. (2004). Diagnóstico microbiológico. 5ª ed. Editorial Panamericana S.A. Argentina.
- Britannia Laboratories. MIO Medio 2015. Disponível em: britanialab.com
- Laboratórios BD. Meio BBL Motility Indol Ornitina (MIO). 2007. Disponível em: bd.com
- Valtek Laboratories. Média M.I.O. Motilidade, Indol, Ornitina. 2010. Disponível em: andinamedica.com


Ainda sem comentários