
Estrutura, propriedades e usos do hidreto de berílio (BeH2)
O hidreto de berílio É um composto covalente formado entre o berílio e o hidrogênio do metal alcalino-terroso. Sua fórmula química é BeHdois, e sendo covalente, não consiste de íonsdois+ nem H-. É, junto com LiH, um dos hidretos metálicos mais leves que podem ser sintetizados.
É produzido pelo tratamento de dimetilberílio, Be (CH3)dois, com hidreto de alumínio e lítio, LiAlH4. No entanto, o BeHdois mais puro é obtido a partir da pirólise de di-terc-butilberil, Be (C (CH3)3)dois a 210 ºC.

Como uma molécula individual no estado gasoso, é linear em geometria, mas no estado sólido e líquido polimeriza em arranjos de redes tridimensionais. É um sólido amorfo em condições normais e pode se tornar cristalino e exibir propriedades metálicas sob enorme pressão..
Ele representa um possível método de armazenamento de hidrogênio, seja como uma fonte de hidrogênio durante a decomposição, seja como um gás de absorção sólido. No entanto, o BeHdois é muito tóxico e poluente, dada a natureza altamente polarizadora do berílio.
Índice do artigo
- 1 Estrutura química
- 1.1 Molécula BeH2
- 1.2 cadeias BeH2
- 1.3 Redes tridimensionais de BeH2
- 2 propriedades
- 2.1 Caráter covalente
- 2.2 Fórmula Química
- 2.3 Aparência física
- 2.4 Solubilidade em água
- 2,5 Solubilidade
- 2.6 Densidade
- 2.7 Reatividade
- 3 usos
- 4 referências
Estrutura química
Molécula BeHdois
A primeira imagem mostra uma única molécula de hidreto de berílio em estado gasoso. Observe que sua geometria é linear, com os átomos de H separados uns dos outros por um ângulo de 180º. Para explicar esta geometria, o átomo Be deve ter hibridização sp.
O berílio tem dois elétrons de valência, que estão localizados no orbital 2s. De acordo com a teoria da ligação de valência, um dos elétrons no orbital 2s é energeticamente promovido ao orbital 2p; e, como consequência, você pode agora formar duas ligações covalentes com os dois orbitais híbridos sp.
E quanto ao resto dos orbitais livres do Be? Dois outros orbitais 2p puros não hibridizados estão disponíveis. Com eles vazios, o BeHdois É um composto com deficiência de elétrons na forma gasosa; e, portanto, conforme suas moléculas se resfriam e se agrupam, elas se condensam e cristalizam em um polímero.
Cadeias BeHdois
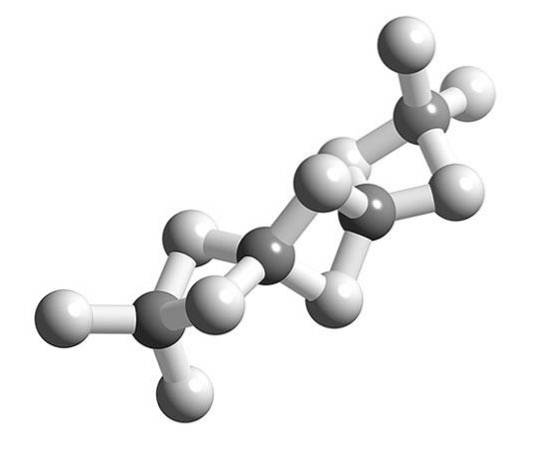
Quando as moléculas BeHdois polimerizar, a geometria circundante do átomo de Be deixa de ser linear e se torna tetraédrica.
Anteriormente, a estrutura deste polímero era modelada como se fossem cadeias com unidades BeHdois ligados por ligações de hidrogênio (imagem superior, com as esferas em tons de branco e acinzentado). Ao contrário das ligações de hidrogênio das interações dipolo-dipolo, elas têm um caráter covalente.
Na ponte Be-H-Be do polímero, dois elétrons são distribuídos entre os três átomos (link 3c, 2e), que teoricamente deveria estar localizado com maior probabilidade em torno do átomo de hidrogênio (sendo mais eletronegativo).
Por outro lado, o Be rodeado por quatro H's consegue preencher relativamente sua vaga eletrônica, completando seu octeto de valência.
Aqui, a teoria da ligação de valência empalidece para dar uma explicação relativamente precisa. Por quê? Porque o hidrogênio só pode ter dois elétrons, e a ligação -H- implicaria na participação de quatro elétrons.
Assim, para explicar as pontes Be-Hdois-Ser (duas esferas cinza unidas por duas esferas brancas) são necessários outros modelos complexos da ligação, como os fornecidos pela teoria orbital molecular.
Verificou-se experimentalmente que a estrutura polimérica de BeHdois não é realmente uma cadeia, mas uma rede tridimensional.
Redes tridimensionais de BeHdois

A imagem superior mostra uma seção da rede tridimensional de BeHdois. Observe que as esferas verdes amareladas, os átomos de Be, formam um tetraedro como na cadeia; no entanto, nesta estrutura há um maior número de ligações de hidrogênio e, além disso, a unidade estrutural não é mais o BeHdois mas o BeH4.
As mesmas unidades estruturais BeHdois e BeH4 indicam que há uma maior abundância de átomos de hidrogênio na rede (4 átomos de H para cada Be).
Isso significa que o berílio dentro dessa rede consegue suprir sua vacância eletrônica ainda mais do que dentro de uma estrutura polimérica em forma de cadeia..
E como a diferença mais óbvia deste polímero em relação à molécula individual de BeHdois, é que o Be deve necessariamente ter uma hibridização sp3 (geralmente) para explicar geometrias tetraédricas e não lineares.
Propriedades
Caráter covalente
Por que o hidreto de berílio é um composto covalente e não iônico? Os hidretos dos demais elementos do grupo 2 (Sr. Becamgbara) são iônicos, ou seja, consistem em sólidos formados por um cátion Mdois+ e dois ânions de hidreto H- (MgHdois, CaHdois, Bahdois) Portanto, o BeHdois não consiste em serdois+ nem H- interagindo eletrostaticamente.
O cátion serdois+ é caracterizado por seu alto poder de polarização, que distorce as nuvens eletrônicas dos átomos circundantes.
Como resultado dessa distorção, os ânions H- eles são forçados a formar ligações covalentes; links, que são a pedra angular das estruturas que acabamos de explicar.
Fórmula química
BeHdois ou (BeHdois) n
Aspecto físico
Sólido amorfo incolor.
Solubilidade em água
Se decompõe.
Solubilidade
Insolúvel em éter dietílico e tolueno.
Densidade
0,65 g / cm3 (1,85 g / L). O primeiro valor pode se referir à fase gasosa e o segundo ao sólido polimérico.
Reatividade
Reage lentamente com água, mas é rapidamente hidrolisado por HCl para formar cloreto de berílio, BeCldois.
O hidreto de berílio reage com bases de Lewis, especificamente trimetilamina, N (CH3)3, para formar um aduto dimérico, com hidretos de ponte.
Além disso, pode reagir com dimetilamina para formar diamida berílio trimérica, [Be (N (CH3)dois)dois]3 e hidrogênio. A reação com hidreto de lítio, onde o íon H- é a base de Lewis, forma sequencialmente LIBeH3 e LidoisBeH4.
Formulários
O hidreto de berílio pode representar uma forma promissora de armazenar hidrogênio molecular. Conforme o polímero se decompõe, ele liberaria Hdois, que serviria como combustível de foguete. A partir desta abordagem, a rede tridimensional armazenaria mais hidrogênio do que as cadeias.
Da mesma forma, como pode ser visto na imagem da rede, existem poros que permitiriam alojar as moléculas H.dois.
Na verdade, alguns estudos simulam a aparência desse armazenamento físico em BeHdois cristalino; ou seja, o polímero submetido a enormes pressões e quais seriam suas propriedades físicas com diferentes quantidades de hidrogênio adsorvido.
Referências
- Wikipedia. (2017). Hidreto de berílio. Recuperado de: en.wikipedia.org
- Armstrong, D.R., Jamieson, J. & Perkins, P.G. Theoret. Chim. Acta (1979) As estruturas eletrônicas de hidreto de berílio polimérico e hidreto de boro polimérico. 51: 163. doi.org/10.1007/BF00554099
- Capítulo 3: Hidreto de berílio e seus oligômeros. Recuperado de: shodhganga.inflibnet.ac.in
- Vikas Nayak, Suman Banger e U. P. Verma. (2014). Estudo do Comportamento Estrutural e Eletrônico do BeHdois como composto de armazenamento de hidrogênio: uma abordagem Ab Initio. Conference Papers in Science, vol. 2014, Artigo ID 807893, 5 páginas. doi.org/10.1155/2014/807893
- Shiver & Atkins. (2008). Química Inorgânica. Em Os elementos do grupo 1. (Quarta edição). Mc Graw Hill.


Ainda sem comentários