
Características, tipos e mecanismo de hidrogenação catalítica
O hidrogenação catalítica É a reação pela qual o hidrogênio molecular é adicionado a um composto em taxas mais altas. A molécula Hdois Não apenas deve primeiro quebrar sua ligação covalente, mas também, sendo tão pequeno, colisões eficientes entre ele e o composto ao qual será adicionado são menos prováveis..
O composto receptor de hidrogênio pode ser orgânico ou inorgânico. Em compostos orgânicos é onde a maioria dos exemplos de hidrogenação catalítica são encontrados; especialmente aqueles que possuem atividade farmacológica, ou que possuem metais incorporados em suas estruturas (compostos organometálicos).
O que acontece quando H é adicionadodois para uma estrutura cheia de carbono? Sua insaturação diminui, ou seja, o carbono atinge o grau máximo de ligações simples que pode formar.
Portanto, o Hdois é adicionado às ligações duplas (C = C) e triplas (C≡C); embora também possa ser adicionado a grupos carbonil (C = O).
Assim, os alcenos e alcinos adicionados reagem por hidrogenação catalítica. Ao analisar superficialmente qualquer estrutura, pode-se prever se adicionará ou não Hdois apenas detectando ligações duplas e triplas.
Índice do artigo
- 1 Características da hidrogenação catalítica
- 1.1 Quebras de ligação de hidrogênio
- 1.2 Experimental
- 2 tipos
- 2.1 Homogêneo
- 2.2 Heterogêneo
- 3 Mecanismo
- 4 referências
Características da hidrogenação catalítica
A imagem mostra o mecanismo dessa reação. No entanto, é necessário abordar alguns aspectos teóricos antes de descrevê-lo.
As superfícies das esferas acinzentadas representam os átomos metálicos que, como se verá, são os catalisadores da hidrogenação por excelência..
Quebra de ligação de hidrogênio
Inicialmente, a hidrogenação é uma reação exotérmica, ou seja, libera calor a partir da formação de compostos com menor energia..
Isso é explicado pela estabilidade das ligações C-H formadas, que requerem mais energia para sua quebra subsequente do que a exigida pela ligação H-H do hidrogênio molecular..
Por outro lado, a hidrogenação sempre envolve quebrar a ligação H-H primeiro. Essa ruptura pode ser homolítica, como acontece em muitos casos:
H-H => H ∙ + ∙ H
Ou heterolítico, que pode ocorrer, por exemplo, quando o óxido de zinco, ZnO, é hidrogenado:
H-H => H+ + H-
Observe que a diferença entre as duas quebras está em como os elétrons da ligação são distribuídos. Se forem distribuídos uniformemente (covalentemente), cada H acaba conservando um elétron; enquanto que se a partição é iônica, acaba-se sem elétrons, H+, e o outro os vence completamente, H-.
Ambas as rupturas são possíveis na hidrogenação catalítica, embora a homolítica permita dar lugar ao desenvolvimento de um mecanismo lógico para isso..
Experimental
O hidrogênio é um gás e, portanto, deve ser borbulhado e deve-se garantir que apenas ele predomine na superfície do líquido..
Por outro lado, o composto a ser hidrogenado deve ser solubilizado em um meio, seja água, álcool, éter, ésteres ou uma amina líquida; caso contrário, a hidrogenação ocorreria muito lentamente.
Dissolvido o composto a ser hidrogenado, deve haver também um catalisador no meio de reação. Este será o responsável por acelerar a velocidade da reação.
Na hidrogenação catalítica, metais finamente divididos de níquel, paládio, platina ou ródio são freqüentemente usados, os quais são insolúveis em quase todos os solventes orgânicos. Portanto, haverá duas fases: uma líquida com o composto e o hidrogênio dissolvidos, e uma sólida, a do catalisador..
Esses metais fornecem sua superfície para que o hidrogênio e o composto reajam, de forma que a quebra das ligações é acelerada..
Da mesma forma, diminuem o espaço de difusão da espécie, aumentando o número de colisões moleculares efetivas. Não só isso, mas até a reação ocorre dentro dos poros do metal..
Tipos
Homogêneo
Falamos de hidrogenação catalítica homogênea quando o meio de reação consiste em uma única fase. Aqui não há lugar para o uso de metais em seu estado puro, pois são insolúveis..
Em vez disso, são usados compostos organometálicos desses metais, os quais são solúveis e apresentam alto rendimento..
Um desses compostos organometálicos é o catalisador de Wilkinson: cloreto de tris (trifenilfosfina) de ródio, [(C6H5)3P]3RhCl. Esses compostos formam um complexo com Hdois, ativando-o para sua reação de adição subsequente a alqueno ou alquino.
A hidrogenação homogênea tem muito mais alternativas do que a heterogênea. Por quê? Porque a química é que os compostos organometálicos são abundantes: basta mudar o metal (Pt, Pd, Rh, Ni) e os ligantes (as moléculas orgânicas ou inorgânicas ligadas ao centro do metal), para obter um novo catalisador.
Heterogêneo
A hidrogenação catalítica heterogênea, como acabamos de mencionar, tem duas fases: uma líquida e outra sólida..
Além dos catalisadores metálicos, existem outros que consistem em uma mistura sólida; por exemplo, o catalisador de Lindlar, que é feito de platina, carbonato de cálcio, acetato de chumbo e quinolina.
O catalisador de Lindlar tem a particularidade de ser deficiente para a hidrogenação de alcenos; Porém, é muito útil para hidrogenações parciais, ou seja, funciona perfeitamente sobre alcinos:
RC≡CR + Hdois => RHC = CHR
Mecanismo
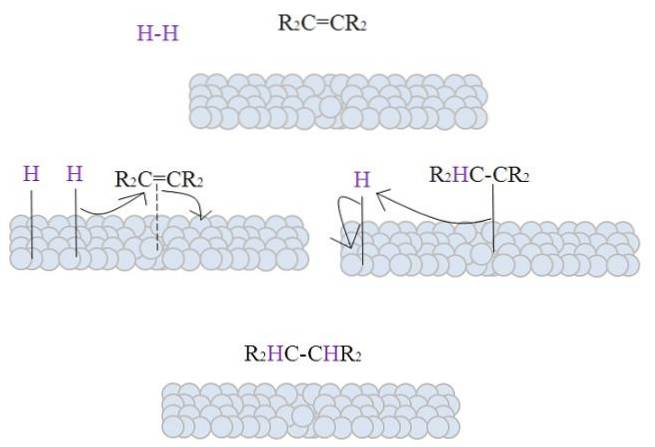
A imagem mostra o mecanismo de hidrogenação catalítica usando metal em pó como catalisador.
As esferas acinzentadas correspondem à superfície metálica de, digamos, platina. A molécula Hdois (cor roxa) se aproxima da superfície do metal, assim como o alceno tetra substituído, RdoisC = CRdois.
O Hdois ele interage com os elétrons que viajam através dos átomos do metal, e ocorre uma ruptura e formação de uma ligação temporária H-M, onde M é o metal. Este processo é conhecido como quimissorção; ou seja, uma adsorção por forças químicas.
O alceno interage de maneira semelhante, mas a ligação é formada por sua ligação dupla (linha pontilhada). A ligação H-H já foi dissociada e cada átomo de hidrogênio permanece ligado ao metal; da mesma forma que o faz com os centros metálicos nos catalisadores organometálicos, formando um complexo intermediário H-M-H.
Em seguida, ocorre a migração de um H em direção à ligação dupla, e esta se abre formando uma ligação com o metal. O H restante então se liga ao outro carbono da ligação dupla original, e o alcano produzido, R, é finalmente liberado.doisHC-CHRdois.
Este mecanismo será repetido quantas vezes forem necessárias, até que todas as Hdois reagiu totalmente.
Referências
- Graham Solomons T.W., Craig B. Fryhle. (2011). Química orgânica. Aminas. (10º edição.). Wiley plus.
- Carey F. (2008). Quimica Organica. (Sexta edição). Mc Graw Hill.
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Lew J. (s.f.). Hidrogenação catalítica de alcenos. Chemistry LibreTexts. Recuperado de: chem.libretexts.org
- Jones D. (2018). O que é hidrogenação catalítica? - Mecanismo e reação. Estudar. Recuperado de: study.com



Ainda sem comentários