
O que é hidrólise e exemplos de reações

O hidrólise É uma reação química que pode ocorrer tanto em moléculas inorgânicas quanto orgânicas ou íons, e que envolve a participação da água para quebrar suas ligações. Seu nome se origina do grego, 'hidro' da água e 'lise' da ruptura.
A molécula de água, HdoisOu, estabelece um equilíbrio com os íons de sais de ácidos e bases fracos, conceito este que aparece pela primeira vez em estudos gerais de química e em química analítica. É, portanto, uma das reações químicas mais simples.
Em vários exemplos de hidrólise, a água sozinha é incapaz de quebrar uma certa ligação covalente. Quando isso acontece, o processo é acelerado ou catalisado pela acidificação ou alcalinização do meio; ou seja, na presença de íons H3OU+ você OH-, respectivamente. Da mesma forma, existem enzimas que catalisam a hidrólise.
A hidrólise ocupa um lugar especial quando se trata de biomoléculas, uma vez que as ligações que mantêm seus monômeros unidos são suscetíveis à hidrólise sob certas condições. Por exemplo, os açúcares são hidrolisados para quebrar os polissacarídeos em seus monossacarídeos constituintes, graças à ação das enzimas glicosidase.
Índice do artigo
- 1 O que é hidrólise?
- 2 Exemplos de reações de hidrólise
- 2.1 - ATP
- 2.2 - Água
- 2.3 - Proteínas
- 2.4 - Amidas e ésteres
- 2,5 - Ácido-base
- 3 referências
O que é hidrólise?
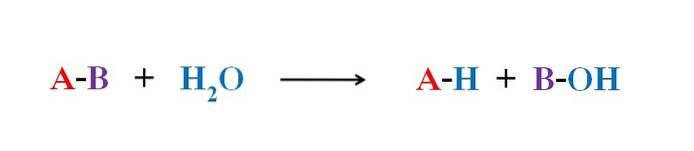
A imagem acima explica em que consiste a hidrólise. Observe que não apenas a molécula ou substrato (se as enzimas mediarem) quebram sua ligação, mas também a própria água, que "se quebra" em H+ e OH-, onde H+ termina com A e OH- com B. A-B, portanto, reage com uma molécula de água produzindo dois produtos, A-H e B-OH.
A hidrólise, portanto, é a reação oposta à condensação. Na condensação dois produtos, dizer A-H e B-OH, unem-se por meio da liberação de uma pequena molécula: a água. Na hidrólise, uma molécula é consumida, enquanto na condensação ela é liberada ou produzida.
Voltando ao exemplo dos açúcares, suponha que A-B corresponda a um dímero de sacarose, onde A representa glicose e B representa frutose. A ligação A-B, glicosídica, pode ser hidrolisada para originar os dois monossacarídeos separadamente e em solução, e o mesmo acontece com os oligo e polissacarídeos se as enzimas mediarem nessas reações..
Observe que nesta reação, A-B, a seta tem apenas uma direção; ou seja, é uma hidrólise irreversível. No entanto, muitas hidrólises são na verdade reações reversíveis que atingem um equilíbrio.
Exemplos de reações de hidrólise
- ATP
O ATP é estável entre valores de pH de 6,8 e 7,4. No entanto, em valores extremos de pH, ele hidrolisa espontaneamente. Nos seres vivos, a hidrólise é catalisada por enzimas conhecidas como ATPases:
ATP + HdoisO => ADP + Pi
Essa reação é fortemente exergônica, uma vez que a entropia do ADP é maior do que a do ATP. A variação da energia livre de Gibbs (ΔGº) é - 30,5 kJ / mol. A energia produzida pela hidrólise do ATP é usada em inúmeras reações endergônicas.
Reações acopladas
Em alguns casos, a hidrólise de ATP é usada para a conversão de um composto (A) em um composto (B).
A + ATP + HdoisOU <=> B + ADP + Pi + H+
- Água
Duas moléculas de água podem reagir entre si na hidrólise aparente:
HdoisO + HdoisOU <=> H3OU+ + Oh-
É como se uma daquelas moléculas de água se quebrasse em H+ e OH-, indo para ligar o H+ ao átomo de oxigênio da outra molécula de água, que dá origem ao íon hidrônio, H3OU+. Esta reação, mais do que a hidrólise, é sobre a autoionização ou autoprotólise da água.
- Proteína
As proteínas são macromoléculas estáveis e para atingir sua hidrólise completa, nos aminoácidos que as constituem, são necessárias condições extremas; como uma concentração de ácido clorídrico (6 M) e altas temperaturas.
No entanto, os seres vivos são dotados de um arsenal enzimático que permite a hidrólise de proteínas em aminoácidos no duodeno. As enzimas envolvidas na digestão das proteínas são quase totalmente secretadas pelo pâncreas.
Existem enzimas exopeptidases que degradam proteínas, começando em suas extremidades: aminopeptidase na extremidade amino e carboxipeptidase na extremidade carboxila. As enzimas endopeptidases exercem sua ação dentro da cadeia protéica, por exemplo: tripsina, pepsina, quimiotripsina, etc..
- Amidas e ésteres
As amidas, quando aquecidas em meio alcalino, dão origem a um ácido carboxílico e uma amina:
RCONHdois + HdoisO => RCOO- + NHdois
Os ésteres em um meio aquoso são hidrolisados em um ácido carboxílico e um álcool. O processo é catalisado por uma base ou um ácido:
RCO-OR '+ HdoisO => RCOOH + R'OH
Esta é a famosa reação de saponificação.
- Base ácida
Na água, várias espécies são hidrolisadas para acidificar ou alcalinizar o meio aquoso.
Adicionar um sal básico
O acetato de sódio, um sal básico, se dissocia na água para dar íons Na+ (sódio) e CH3COO- (acetato). Sua basicidade se deve ao fato do acetato ser hidrolisado para gerar íons OH-, enquanto o sódio permanece inalterado:
CH3COO- + HdoisOU <=> CH3COOH + OH-
O OH- é responsável pelo aumento do pH e se torna básico.
Adicionar um sal ácido
Cloreto de amônio (NH4Cl) é formado pelo íon cloreto (Cl-) a partir de ácido clorídrico (HCl), um ácido forte e o cátion amônio (NH4+) de hidróxido de amônio (NH4OH), uma base fraca. O Cl- Não se dissocia na água, mas o cátion amônio se transforma em água da seguinte forma:
NH4+ + HdoisOU <=> NH3 + H3OU+
A hidrólise do cátion amônio produz prótons que aumentam a acidez de um meio aquoso, portanto, conclui-se que o NH4Cl é um sal ácido.
Adicionar um sal neutro
O cloreto de sódio (NaCl) é um produto salino da reação de uma base forte (NaOH) com um ácido forte (HCl). Ao dissolver o cloreto de sódio em água, o cátion sódio (Na+) e o ânion (Cl-) Ambos os íons não se dissociam na água, então eles não adicionam H+ você OH-, mantendo seu pH constante.
Portanto, o cloreto de sódio é considerado um sal neutro..
Referências
- Mathews, C. K., van Holde, K. E. e Ahern, K. G. (2002). Bioquímica. (Terceira edição). Editar. Pearson-Addison Wesley.
- Whitten, Davis, Peck & Stanley. (2008). Química. (8ª ed.). CENGAGE Learning.
- Helmenstine, Anne Marie, Ph.D. (13 de janeiro de 2019). Hidrólise: Definição e Exemplos. Recuperado de: Thoughtco.com
- Theresa Phillips. (28 de abril de 2019). Uma explicação do processo de hidrólise. Recuperado de: thebalance.com
- Os editores da Encyclopaedia Britannica. (2016, 16 de novembro). Hidrólise. Encyclopædia Britannica. Recuperado de: britannica.com
- Wikipedia. (2019). Hidrólise. Recuperado de: en.wikipedia.org


Ainda sem comentários