
Tipos, processos e funções de glicosilação de proteínas

O glicosilação de proteínas É uma modificação pós-tradução que consiste na adição de cadeias de oligossacarídeos lineares ou ramificadas a uma proteína. As glicoproteínas resultantes são geralmente proteínas de superfície e proteínas da via secretora..
A glicosilação é uma das modificações de peptídeos mais comuns entre os organismos eucarióticos, mas foi demonstrado que ocorre em algumas espécies de arquéias e bactérias também..
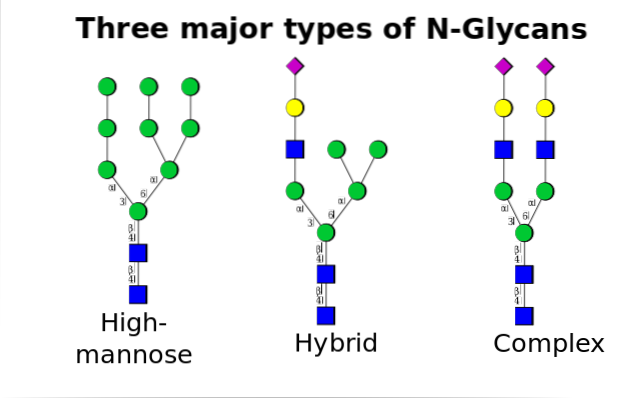
Nos eucariotos, esse mecanismo ocorre entre o retículo endoplasmático (RE) e o complexo de Golgi, com a intervenção de diferentes enzimas envolvidas tanto nos processos regulatórios quanto na formação das ligações covalentes proteína + oligossacarídeo..
Índice do artigo
- 1 Tipos de glicólise
- 1,1 N-glicosilação
- 1.2 O-glicosilação
- 1.3 C-manosilação
- 1.4 Glypiation (do inglês "Glypiation")
- 2 processos
- 2.1 Em eucariotos
- 2.2 Em procariontes
- 3 funções
- 3.1 Importância
- 4 referências
Tipos de glicólise
Dependendo do local de ligação do oligossacarídeo à proteína, a glicosilação pode ser classificada em 4 tipos:
N-glicosilação
É o mais comum de todos e ocorre quando os oligossacarídeos se ligam ao nitrogênio do grupo amida dos resíduos de asparagina no motivo Asn-X-Ser / Thr, onde X pode ser qualquer aminoácido, exceto prolina.
OU-glicosilação
Quando os carboidratos estão ligados ao grupo hidroxila da serina, treonina, hidroxilisina ou tirosina. É uma modificação menos comum e são exemplos de proteínas como colágeno, glicoforina e mucinas..
C-manosilação
Consiste na adição de um resíduo de manose que se liga à proteína por uma ligação C-C com o C2 do grupo indol em resíduos de triptofano..
Glipiação (do inglês “Glipiação ")
Um polissacarídeo atua como uma ponte para anexar uma proteína a uma âncora de glicosilfosfatidilinositol (GPI) na membrana.
Processar
Em eucariotos
O N-a glicosilação é a que vem sendo estudada com mais detalhes. Em células de mamíferos, o processo começa no ER bruto, onde um polissacarídeo pré-formado se liga às proteínas à medida que emergem dos ribossomos..
O referido polissacarídeo precursor é composto por 14 resíduos de açúcar, a saber: 3 resíduos de glicose (Glc), 9 manose (Man) e 2 resíduos de N-acetil glucosamina (GlcNAc).
Este precursor é comum em plantas, animais e organismos eucarióticos unicelulares. É ligado à membrana graças a uma ligação com uma molécula de dolicol, um lipídio isoprenóide embutido na membrana ER..
Após sua síntese, o oligossacarídeo é transferido pelo complexo da enzima oligossacriltransferase para um resíduo de asparagina incluído na sequência tri-peptídica Asn-X-Ser / Thr de uma proteína enquanto está sendo traduzido.
Os três resíduos Glc no final do oligossacarídeo servem como um sinal para a síntese correta do oligossacarídeo e são clivados juntamente com um dos resíduos Man antes da proteína ser transportada para o aparelho de Golgi para processamento posterior..
Uma vez no aparelho de Golgi, as porções de oligossacarídeo ligadas às glicoproteínas podem ser modificadas pela adição de galactose, ácido siálico, fucose e muitos outros resíduos, produzindo cadeias de variedade e complexidade muito maiores..
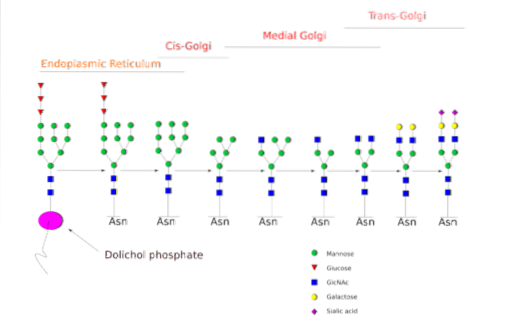
A maquinaria enzimática necessária para realizar os processos de glicosilação inclui numerosas glicosiltransferases para a adição de açúcares, glicosidases para sua remoção e diferentes transportadores de açúcar de nucleotídeo para a contribuição dos resíduos usados como substratos..
Em procariontes
As bactérias não possuem sistemas de membrana intracelular, então a formação do oligossacarídeo inicial (de apenas 7 resíduos) ocorre no lado citosólico da membrana plasmática..
O referido precursor é sintetizado em um lipídio que é então translocado por uma flipase dependente de ATP para o espaço periplasmático, onde ocorre a glicosilação..
Outra diferença importante entre a glicosilação eucariótica e procariótica é que a enzima oligossacarídeo transferase (oligossacariltransferase) da bactéria pode transferir resíduos de açúcar para porções livres de proteínas já dobradas, não conforme elas são traduzidas pelos ribossomos..
Além disso, o motivo peptídico reconhecido por esta enzima não é a mesma sequência tripeptídica eucariótica..
Características
O N-os oligossacáridos ligados às glicoproteínas têm vários fins. Por exemplo, algumas proteínas requerem esta modificação pós-tradução para alcançar o dobramento adequado de sua estrutura..
Para outros, proporciona estabilidade, seja por evitar a degradação proteolítica, seja porque essa porção é necessária para que cumpram sua função biológica..
Como os oligossacarídeos têm um forte caráter hidrofílico, sua adição covalente a uma proteína modifica necessariamente sua polaridade e solubilidade, o que pode ter relevância do ponto de vista funcional..
Uma vez ligados às proteínas da membrana, os oligossacarídeos são portadores de informações valiosas. Eles participam dos processos de sinalização, comunicação, reconhecimento, migração e adesão celular.
Eles têm um papel importante na coagulação do sangue, cicatrização e resposta imunológica, bem como no processamento do controle de qualidade da proteína, que é dependente de glicano e indispensável para a célula..
Importância
Pelo menos 18 doenças genéticas foram associadas à glicosilação de proteínas em humanos, algumas das quais envolvem baixo desenvolvimento físico e mental, enquanto outras podem ser fatais.
Há um número crescente de descobertas relacionadas às doenças da glicosilação, principalmente em pacientes pediátricos. Muitos desses distúrbios são congênitos e têm a ver com defeitos associados aos estágios iniciais da formação de oligossacarídeos ou à regulação das enzimas que participam desses processos..
Como grande parte das proteínas glicosiladas compõem o glicocálice, há um interesse crescente em verificar se mutações ou alterações nos processos de glicosilação podem estar relacionadas à mudança no microambiente das células tumorais e, assim, promover a progressão de tumores e o desenvolvimento de metástases em pacientes com câncer.
Referências
- Aebi, M. (2013). Glicosilação de proteína ligada a N no ER. Biochimica et Biophysica Acta, 1833(11), 2430-2437.
- Dennis, J. W., Granovsky, M., & Warren, C. E. (1999). Glicosilação de proteínas no desenvolvimento e doença. BioEssays, vinte e um(5), 412-421.
- Lodish, H., Berk, A., Kaiser, C. A., Krieger, M., Bretscher, A., Ploegh, H.,… Martin, K. (2003). Biologia Molecular Celular (5ª ed.). Freeman, W. H. & Company.
- Luckey, M. (2008). Biologia estrutural da membrana: com fundamentos bioquímicos e biofísicos. Cambridge University Press. Obtido em www.cambrudge.org/9780521856553
- Nelson, D. L., & Cox, M. M. (2009). Princípios de Bioquímica de Lehninger. Edições Omega (5ª ed.).
- Nothaft, H., & Szymanski, C. M. (2010). Glicosilação de proteínas em bactérias: mais doce do que nunca. Nature Reviews Microbiology, 8(11), 765-778.
- Ohtsubo, K., & Marth, J. D. (2006). Glicosilação em mecanismos celulares de saúde e doença. Célula, 126(5), 855-867.
- Spiro, R. G. (2002). Glicosilação de proteínas: natureza, distribuição, formação enzimática e implicações de doenças das ligações glicopeptídicas. Glicobiologia, 12(4), 43R-53R.
- Stowell, S. R., Ju, T., & Cummings, R. D. (2015). Glicosilação de proteínas em câncer. Revisão Anual de Patologia: Mecanismos de Doença, 10(1), 473-510.
- Strasser, R. (2016). Glicosilação de proteínas vegetais. Glicobiologia, 26(9), 926-939.
- Xu, C., & Ng, D. T. W. (2015). Controle de qualidade direcionado por glicosilação de dobramento de proteínas. Nature Reviews Molecular Cell Biology, 16(12), 742-752.
- Zhang, X., & Wang, Y. (2016). Controle de qualidade de glicosilação pela estrutura de Golgi. Journal of Molecular Biology, 428(16), 3183-3193.


Ainda sem comentários