
Link Pi como é formado, características e exemplos
UMA link pi (π) é um tipo de ligação covalente caracterizada por impedir o movimento de rotação livre dos átomos e por originar-se entre um par de orbitais atômicos do tipo puro, entre outras peculiaridades. Existem ligações que podem ser formadas entre os átomos por seus elétrons, o que lhes permite construir estruturas maiores e mais complexas: moléculas.
Essas ligações podem ser de diferentes variedades, mas as mais comuns neste campo de estudo são as covalentes. As ligações covalentes, também chamadas de ligações moleculares, são um tipo de ligação em que os átomos envolvidos compartilham pares de elétrons.
Isso pode ocorrer devido à necessidade dos átomos em buscar estabilidade, formando assim a maioria dos compostos conhecidos. Nesse sentido, as ligações covalentes podem ser simples, duplas ou triplas, dependendo da configuração de seus orbitais e do número de pares de elétrons compartilhados entre os átomos envolvidos..
É por isso que existem dois tipos de ligações covalentes que são formadas entre os átomos com base na orientação de seus orbitais: ligações sigma (σ) e ligações pi (π)..
É importante diferenciar as duas ligações, uma vez que a ligação sigma ocorre em ligações simples e pi em ligações múltiplas entre átomos (dois ou mais elétrons são compartilhados).
Índice do artigo
- 1 Como é formado?
- 1.1 Formação de ligações pi em diferentes espécies químicas
- 2 recursos
- 3 exemplos
- 4 referências
Como se forma?
Para descrever a formação da ligação pi, o processo de hibridização deve primeiro ser discutido, uma vez que intervém em algumas ligações importantes..
A hibridização é um processo no qual orbitais eletrônicos híbridos são formados; isto é, onde os orbitais de subnível atômico se p podem se misturar. Isso causa a formação de orbitais sp, spdois e sp3, que são chamados de híbridos.
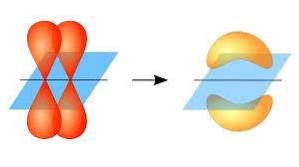
Nesse sentido, a formação das ligações pi ocorre graças à sobreposição de um par de lóbulos pertencentes a um orbital atômico sobre outro par de lóbulos que estão em um orbital que faz parte de outro átomo..
Esta sobreposição orbital ocorre lateralmente, por meio da qual a distribuição eletrônica é principalmente concentrada acima e abaixo do plano formado pelos núcleos atômicos ligados, e faz com que as ligações pi sejam mais fracas do que as ligações sigma..
Ao se falar sobre a simetria orbital desse tipo de união, deve-se mencionar que ela é igual à dos orbitais tipo p desde que observada através do eixo formado pela união. Além disso, essas uniões são compostas principalmente de orbitais p..
Formação de ligações pi em diferentes espécies químicas
Como as ligações pi são sempre acompanhadas por uma ou duas mais ligações (um sigma ou outro pi e um sigma), é relevante saber que a dupla ligação que se forma entre dois átomos de carbono (composta por um sigma e uma ligação pi) tem menor energia de ligação do que o correspondente a duas vezes a ligação sigma entre os dois.
Isso se explica pela estabilidade da ligação sigma, que é maior que a da ligação pi, pois a sobreposição dos orbitais atômicos nesta última ocorre de forma paralela nas regiões acima e abaixo dos lobos, acumulando a distribuição eletrônica de forma mais caminho distante. de núcleos atômicos.
Apesar disso, quando as ligações pi e sigma são combinadas, uma ligação múltipla mais forte é formada do que a própria ligação simples, o que pode ser verificado observando os comprimentos de ligação entre vários átomos de ligação simples e múltiplos..
Existem algumas espécies químicas que são estudadas por seu comportamento excepcional, como os compostos de coordenação com elementos metálicos, nos quais os átomos centrais estão ligados apenas por ligações pi..
Caracteristicas
As características que distinguem as ligações pi de outros tipos de interação entre as espécies atômicas são descritas a seguir, começando com o fato de que essa ligação não permite o movimento rotacional livre de átomos, como o carbono. Por esse motivo, se houver rotação dos átomos, o vínculo se rompe..
Da mesma forma, nestes elos a sobreposição entre os orbitais ocorre através de duas regiões paralelas, conseguindo que eles tenham uma difusão maior que os elos sigma e que, por isso, sejam mais fracos..
Por outro lado, como mencionado acima, a ligação pi é sempre gerada entre um par de orbitais atômicos puros; Isso significa que ele é gerado entre orbitais que não passaram por processos de hibridização, nos quais a densidade dos elétrons está concentrada principalmente acima e abaixo do plano formado pela ligação covalente..
Nesse sentido, entre um par de átomos pode haver mais de uma ligação pi, sempre acompanhada por uma ligação sigma (nas ligações duplas).
Da mesma forma, pode haver uma ligação tripla entre dois átomos adjacentes, que é formada por duas ligações pi em posições que formam planos perpendiculares entre si e uma ligação sigma entre os dois átomos..
Exemplos
Como afirmado anteriormente, as moléculas compostas de átomos unidos por uma ou mais ligações pi sempre têm ligações múltiplas; ou seja, duplica ou triplica.
Um exemplo disso é a molécula de etileno (HdoisC = CHdois), que é constituído por uma ligação dupla; ou seja, um pi e uma ligação sigma entre seus átomos de carbono, além das ligações sigma entre os carbonos e hidrogênios.
Por sua vez, a molécula de acetileno (H-C≡C-H) possui uma ligação tripla entre seus átomos de carbono; ou seja, duas ligações pi formando planos perpendiculares e uma ligação sigma, além de suas ligações sigma carbono-hidrogênio correspondentes.
As ligações Pi também ocorrem entre as moléculas cíclicas, como o benzeno (C6H6) e seus derivados, cujo arranjo resulta em um efeito denominado ressonância, que permite que a densidade do elétron migre entre os átomos e conceda, entre outras coisas, maior estabilidade ao composto..
Para exemplificar as exceções mencionadas anteriormente, os casos da molécula de dicarbonato (C = C, em que ambos os átomos possuem um par de elétrons emparelhados) e o composto de coordenação denominado hexacarbonil ferro (representado como Fedois(CO)6, que é formado apenas por ligações pi entre seus átomos).
Referências
- Wikipedia. (s.f.). Vínculo Pi. Recuperado de en.wikipedia.org
- Chang, R. (2007). Química, nona edição. México: McGraw-Hill.
- ThoughtCo. (s.f.). Pi Bond Definition in Chemistry. Recuperado de Thoughtco.com
- Britannica, E. (s.f.). Vínculo Pi. Obtido em britannica.com
- LibreTexts. (s.f.). Sigma e Pi Bonds. Recuperado de chem.libretexts.org
- Srivastava, A. K. (2008). Química orgânica simplificada. Recuperado de books.google.co.ve



Ainda sem comentários