
Explicação da equação de Henderson-Hasselbalch, exemplos, exercício
O Equação de Henderson-Hasselbalch é uma expressão matemática que permite o cálculo do pH de um buffer ou solução buffer. Baseia-se no pKa do ácido e na relação entre as concentrações da base ou sal conjugado e o ácido, presente na solução tampão..
A equação foi desenvolvida inicialmente por Lawrence Joseph Henderson (1878-1942) em 1907. Este químico estabeleceu os componentes de sua equação com base no ácido carbônico como tampão ou tampão..
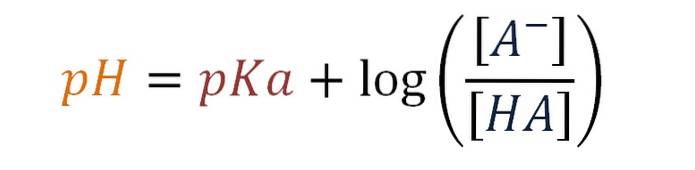
Mais tarde, Karl Albert Hasselbalch (1874-1962) introduziu em 1917 o uso de logaritmos para complementar a equação de Henderson. O químico dinamarquês estudou as reações do sangue com o oxigênio e o efeito em seu pH.
Uma solução tampão é capaz de minimizar as mudanças de pH que uma solução sofre adicionando um volume de ácido ou base forte. É composto de um ácido fraco e sua base conjugada forte que se dissocia rapidamente.
Índice do artigo
- 1 explicação
- 1.1 Desenvolvimento matemático
- 1.2 Equação para uma base fraca
- 2 Como funciona um buffer?
- 2.1 Ação de amortecimento
- 2.2 Capacidade do buffer
- 3 exemplos de equações de Henderson
- 3.1 Amortecedor de acetato
- 3.2 Tampão de ácido carbônico
- 3.3 Tampão de lactato
- 3.4 Tampão Fosfato
- 3,5 Oxihemoglobina
- 3.6 Desoxiemoglobina
- 4 exercícios resolvidos
- 4.1 Exercício 1
- 4.2 Exercício 2
- 4.3 Exercício 3
- 5 referências
Explicação
Desenvolvimento matemático
Um ácido fraco em solução aquosa se dissocia de acordo com a Lei de Ação de Massa, de acordo com o seguinte esquema:
HA + HdoisO ⇌ H+ + PARA-
HA é o ácido fraco e A- sua base conjugada.
Esta reação é reversível e tem uma constante de equilíbrio (Ka):
Ka = [H+] ·[PARA-] / [HA]
Fazendo logaritmos:
log Ka = log [H+] + Log [A-] - log [HA]
Se cada termo da equação for multiplicado por (-1), ele será expresso da seguinte forma:
- log Ka = - log [H+] - log [A] + log [HA]
O - log Ka é definido como pKa e o - log [H+] é definido como pH. Depois de fazer a substituição adequada, a expressão matemática se reduz a:
pKa = pH - log [A-] + Log [HA]
Resolvendo para pH e termos de reagrupamento, a equação é expressa da seguinte forma:
pH = pKa + log [A-] / [HA]
Esta é a equação de Henderson-Hasselbalch para um tampão de ácido fraco.
Equação para uma base fraca
Da mesma forma, uma base fraca pode formar um buffer, e a equação de Henderson-Hasselbalch para isso é a seguinte:
pOH = pKb + log [HB] / [B-]
No entanto, a maioria das soluções tampão são originadas, mesmo aquelas de importância fisiológica, da dissociação de um ácido fraco. Portanto, a expressão mais usada para a equação de Henderson-Hasselbalch é:
pH = pKa + log [A-] / [HA]
Como funciona um buffer?
Ação de amortecimento
A equação de Henderson-Hasselbalch indica que esta solução é composta por um ácido fraco e uma base conjugada forte expressa como um sal. Esta composição permite que a solução tampão permaneça a um pH estável, mesmo quando ácidos ou bases fortes são adicionados..
Quando um ácido forte é adicionado ao tampão, ele reage com a base conjugada para formar um sal e água. Isso neutraliza o ácido e permite que a variação do pH seja mínima..
Agora, se uma base forte for adicionada ao tampão, ele reage com o ácido fraco e forma água e um sal, neutralizando a ação da base adicionada sobre o pH. Portanto, a variação do pH é mínima.
O pH de uma solução tampão depende da proporção das concentrações da base conjugada e do ácido fraco, e não do valor absoluto das concentrações desses componentes. Uma solução tampão pode ser diluída com água e o pH ficará praticamente inalterado.
Capacidade tampão
A capacidade tampão também depende do pKa do ácido fraco, bem como das concentrações do ácido fraco e da base conjugada. Quanto mais próximo o pH do tampão estiver do pKa do ácido, maior será sua capacidade tampão..
Da mesma forma, quanto maior for a concentração dos componentes da solução tampão, maior será a sua capacidade tampão..
Exemplos de equações de Henderson
Amortecedor de acetato
pH = pKa + log [CH3COO-] / [CH3COOH]
pKa = 4,75
Tampão de ácido carbônico
pH = pKa + log [HCO3-] / [HdoisCO3]
pKa = 6,11
No entanto, o processo geral que leva à formação do íon bicarbonato em um organismo vivo é o seguinte:
COdois + HdoisO ⇌ HCO3- + H+
Ser o COdois um gás, sua concentração em solução é expressa em função de sua pressão parcial.
pH = pka + log [HCO3-] / α pCOdois
α = 0,03 (mmol / L) / mmHg
pCOdois é a pressão parcial de COdois
E então a equação ficaria assim:
pH = pKa + log [HCO3-] / 0,03 pCOdois
Tampão de lactato
pH = pKa + log [íon lactato] / [ácido lático]
pKa = 3,86
Tampão Fosfato
pH = pKa + log [fosfato dibásico] / [fosfato monobásico]
pH = pKa + log [HPO4dois-] / [HdoisPO4-]
pKa = 6,8
Oxiemoglobina
pH = pKa + log [HbOdois-] / [HHbOdois]
pKa = 6,62
Desoxiemoglobina
pH = pKa + log [Hb-] / HbH
pKa = 8,18
Exercícios resolvidos
Exercício 1
O tampão fosfato é importante na regulação do pH corporal, pois seu pKa (6,8) está próximo ao pH existente no corpo (7,4). Qual será o valor da relação [NadoisHPO4dois-] / [NaHdoisPO4-] da equação de Henderson-Hasselbalch para um valor de pH = 7,35 e um pKa = 6,8?
A reação de dissociação do NaHdoisPO4- isso é:
NaHdoisPO4- (ácido) ⇌ NaHPO4dois- (base) + H+
pH = pKa + log [NadoisHPO4dois-] / [NaHdoisPO4-]
Resolvendo a razão [base / ácido conjugado] para o tampão de fosfato, temos:
7,35 - 6,8 = log [NadoisHPO4dois-] / [NaHdoisPO4-]
0,535 = log [NadoisHPO4dois-] / [NaHdoisPO4-]
100,535 = 10log [Na2HPO4] / [NaH2PO4]
3,43 = [NadoisHPO4dois-] / [NaHdoisPO4-]
Exercício 2
Um tampão de acetato tem uma concentração de ácido acético de 0,0135 M e uma concentração de acetato de sódio de 0,0260 M. Calcule o pH do tampão, sabendo que o pKa para o tampão de acetato é 4,75.
O equilíbrio de dissociação para ácido acético é:
CH3COOH ⇌ CH3COO- + H+
pH = pKa + log [CH3COO-] / [CH3COOH]
Substituindo os valores que temos:
[CH3COO-] / [CH3COOH] = 0,0260 M / 0,0135 M
[CH3COO-] / [CH3COOH] = 1,884
log 1,884 = 0,275
pH = 4,75 + 0,275
pH = 5,025
Exercício 3
Um tampão de acetato contém 0,1 M de ácido acético e 0,1 M de acetato de sódio. Calcule o pH do tampão após adicionar 5 mL de ácido clorídrico 0,05 M a 10 mL da solução acima.
A primeira etapa é calcular a concentração final do HCl quando misturado com a solução tampão:
ViCi = VfCf
Cf = Vi · (Ci / Vf)
= 5 mL · (0,05 M / 15 mL)
= 0,017 M
O ácido clorídrico reage com o acetato de sódio para formar ácido acético. Portanto, a concentração de acetato de sódio diminui em 0,017 M e a concentração de ácido acético aumenta na mesma quantidade:
pH = pKa + log (0,1 M - 0,017 M) / (0,1 M + 0,017 M)
pH = pKa + log 0,083 / 0,017
= 4,75 - 0,149
= 4,601
Referências
- Whitten, Davis, Peck & Stanley. (2008). Química. (8ª ed.). CENGAGE Learning.
- Jimenez Vargas e J. Mª Macarulla. (1984). Físicoquímica Fisiológica. 6ª edição. Editorial Interamericana.
- Wikipedia. (2020). Equação de Henderson-Hasselbalch. Recuperado de: en.wikipedia.org
- Gurinder Khaira e Alexander Kot. (5 de junho de 2019). Aproximação de Henderson-Hasselbalch. Chemistry LibreTexts. Recuperado de: chem.libretexts.org
- Helmenstine, Anne Marie, Ph.D. (29 de janeiro de 2020). Definição da equação de Henderson Hasselbalch. Recuperado de: Thoughtco.com
- Os editores da Encyclopaedia Britannica. (6 de fevereiro de 2020). Lawrence Joseph Henderson. Encyclopædia Britannica. Recuperado de: britannica.com



Ainda sem comentários