
Estrutura, propriedades, usos, riscos do clorito de sódio (NaClO2)

O Clorito de sódio é um sólido inorgânico formado por um íon sódio Na+ e um íon clorito ClOdois-. Sua fórmula química é NaClOdois. É um sólido cristalino de cor branca, além de ser um forte agente oxidante. Portanto, deve ser manuseado com muito cuidado..
Seu principal uso é como agente desinfetante para muitas aplicações. Elimina micróbios em superfícies como pisos, paredes e equipamentos de laboratório em hospitais e clínicas e em seus sistemas de água.

Também em instalações agrícolas e veterinárias, para higienizar incubadoras de ovos de aves, para controlar infecções de úberes de vacas leiteiras, para desinfetar sistemas de água para animais, etc..
Na indústria de alimentos, suas soluções aquosas acidificadas são utilizadas na lavagem de carnes, frangos, frutas, vegetais, bem como nos equipamentos dessas instalações..
O dióxido de cloro pode ser preparado com clorito de sódio.dois no local de uso, o que permite eliminar micróbios, maus odores e sabores da água para que seja agradável e possa ser bebida sem problemas.
Também é usado para branquear celulose de papel, fibras têxteis vegetais e óleos, entre outras aplicações..
NaClOdois O sólido deve ser manuseado com cuidado, pois em contato com certos materiais podem ocorrer explosões. Suas soluções são um pouco mais fáceis de manusear, mas são muito oxidantes e corrosivas..
Índice do artigo
- 1 Estrutura
- 2 Nomenclatura
- 3 propriedades
- 3.1 Estado físico
- 3.2 Peso molecular
- 3.3 Ponto de fusão
- 3.4 Densidade
- 3.5 Solubilidade
- 3.6 Outras propriedades
- 4 riscos
- 5 Obtendo
- 6 usos
- 6.1 Como microbicida e desinfetante em múltiplas aplicações
- 6.2 Para desinfetar a água potável
- 6.3 Para cuidados com lentes de contato
- 6.4 Em várias aplicações
- 7 referências
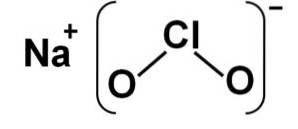
Estrutura
O clorito de sódio é composto por um cátion sódio Na+ e um ânion clorito ClOdois- portanto, eles são unidos por uma ligação iônica.
O ânion clorito possui um átomo de cloro em um estado de oxidação de +3 e dois átomos de oxigênio com valência -2 cada. Por esse motivo, o ânion clorito tem carga negativa..
Ele também tem uma estrutura em forma de ângulo.
Nomenclatura
- Clorito de sódio
- Clorito de sódio
- Sal de sódio de ácido cloroso
Propriedades
Estado físico
Sólido branco cristalino.
Peso molecular
90,44 g / mol.
Ponto de fusão
Ele se decompõe à medida que derrete entre 180 e 200 ºC.
Densidade
2,468 g / cm3
Solubilidade
Solúvel em água: 64 g / 100 g de água a 17 ºC. Ligeiramente solúvel em metanol.
Outras propriedades
É ligeiramente higroscópico.
É um forte agente oxidante. Reage violentamente com materiais combustíveis e redutores. Reage violentamente com ácidos, gerando dióxido de cloro ClOdois.
Suas soluções alcalinas (significa na presença de, por exemplo, NaOH) são bastante estáveis, enquanto em um meio ácido cloroso ácido HClO é formadodois, que se decompõe rapidamente:
4 HClOdois → 2 ClOdois↑ + ClO3- + Cl- + 2 h+ + HdoisOU
Riscos
Ambos NaClOdois Sólido, pois suas soluções aquosas são potencialmente perigosas e requerem muito cuidado e experiência durante o manuseio e armazenamento..
NaClOdois sólido pode explodir em contato com substâncias orgânicas, incluindo luvas e roupas, materiais de controle de derramamento, como serragem e resíduos de algodão, bem como óleos e graxas.
A forma sólida é portanto muito difícil de transportar e é preferível utilizá-la na forma de soluções aquosas..
Essas soluções são extremamente corrosivas. Devem ser mantidos preferencialmente em um pH acima de 8, ou seja, um pH alcalino.
NaClOdois acelera a combustão de compostos ou materiais inflamáveis, a ponto de poder formar misturas explosivas com eles.
Se aquecido, emite gases tóxicos de ácido clorídrico HCl e óxido de sódio NadoisO. A exposição prolongada ao calor ou fogo pode explodir.
Obtendo
É preparado a partir da redução química ou eletroquímica do clorato de sódio NaClO3, na presença de ácido clorídrico HCl para produzir dióxido de cloro ClOdois.
Este último reage com peróxido de hidrogênio HdoisOUdois em solução aquosa de hidróxido de sódio NaOH e uma solução de clorito de sódio NaClO é obtidadois, que evapora e o sólido cristaliza.
Também pode ser obtido pela passagem do gás dióxido de cloro ClOdois por uma solução de NaOH.
2 ClOdois + 2 NaOH → NaClOdois + NaClO3 + HdoisOU
Formulários
Como microbicida e desinfetante em múltiplas aplicações
É um ingrediente de vários produtos usados para controlar bactérias, fungos e lamas de algas. Os produtos que o contêm para este fim são utilizados na agricultura, comércio, indústria e residências ou residências..
Serve como desinfetante para muitos tipos de materiais e superfícies.
Na agricultura, avicultura e indústrias semelhantes, superfícies duras, equipamentos, instalações para incubação de ovos de aves, estufas para fungos como cogumelos e água de resfriamento e sistemas de água para aviários são desinfetados..
Tem uso veterinário como desinfetante tópico no controle da mastite em gado leiteiro, para submergir os mamilos do animal. A mastite é uma infecção dos úberes das vacas.

Também é usado em estabelecimentos de pesquisa natural para descontaminar laboratórios.
Os usos comerciais, industriais e médicos incluem a desinfecção de sistemas de ventilação, superfícies duras (como pisos, paredes, equipamentos de laboratório) e sistemas de água..
Em instalações de saúde, como clínicas e hospitais, é usado para descontaminar salas, corredores, áreas de isolamento e para a esterilização de materiais.
Também é útil para higienização em estabelecimentos onde as pessoas fazem tratamentos de saúde com água ou spa.
Na indústria de alimentos é usado como fumigante para conservar alimentos.
É utilizado na forma de clorito de sódio acidificado. Isso é produzido pela adição de ácido de qualidade alimentar (por exemplo, ácido cítrico, ácido fosfórico, ácido málico ou sulfato de ácido de sódio) a uma solução aquosa de clorito de sódio..
O clorito de sódio acidificado tem propriedades antimicrobianas e é usado como spray ou solução de lavagem ou imersão para frango, carnes, vegetais, frutas e frutos do mar. Também na água para congelar frango ou aves.
Nas residências, permite a desinfecção de superfícies duras, como pisos e banheiros, sistemas de aquecimento ou ar condicionado e sistemas de circulação de água de piscinas..


Também é vendido em pequenos sachês junto com outros compostos para liberar gases e controlar odores nas casas..
Para desinfetar a água potável
É utilizado na purificação da água potável, atua como oxidante, melhorando o sabor e o cheiro da água potável.
O clorito de sódio é amplamente utilizado como um precursor para a geração de dióxido de cloro ClOdois usado no tratamento de água potável para consumo humano, ou seja, para eliminar microrganismos, odores e sabores desagradáveis e pode ser bebida.
Para gerar o ClOdois HCl pode ser usado:
5 NaClOdois + 4 HCl → 4 ClOdois↑ + 5 NaCl + 2 HdoisOU
The ClOdois é um agente antimicrobiano de alta ação oxidante e amplo espectro. Ou seja, atua contra um grande número de microrganismos.
Os microrganismos são inativados porque ClOdois interfere com enzimas importantes destes e com as proteínas das membranas celulares. Também tem a vantagem de não produzir compostos organoclorados, que são tóxicos..
Existem comprimidos de clorito de sódio à venda misturados com outros compostos que se dissolvem na água e imediatamente produzem ClOdois de forma controlada, desinfetando assim a água.

O principal problema de tratar a água para remover sabores e odores com ClOdois é que os sais tóxicos de clorito e clorato podem ser formados durante o tratamento.
Para cuidados com lentes de contato
NaClOdois é um componente das soluções que servem para desinfetar lentes de contato.
Uma combinação de NaClO é usadadois e traços (quantidades muito pequenas) de peróxido de hidrogênio HdoisOUdois.
O HdoisOUdois estabiliza ClOdois que se forma e a combinação de ambos é muito eficaz contra bactérias, fungos e leveduras. Os produtos resultantes são cloreto de sódio NaCl, água e oxigênio, que são inofensivos, o que significa que não são prejudiciais aos olhos.
Quando as lentes são removidas da solução, o NaClOdois O resíduo se decompõe rapidamente em NaCl e Odois. O peróxido residual não irrita os olhos. Portanto, essas soluções são muito seguras.

Em várias aplicações
Clorito de sódio é usado para a preparação de dióxido de cloro ClOdois para uso imediato em um grande número de aplicações, algumas das quais foram discutidas nos parágrafos anteriores.
É usado para branquear polpa de madeira, têxteis como algodão, fibras vegetais, óleos comestíveis e não comestíveis, gorduras, vernizes, lacas e ceras.
É um componente do colírio e de algumas soluções para bochechos..
É utilizado na indústria de processamento de couro e em agentes para galvanoplastia de metais (revestimento metálico).
Referências
- Williams, L. et al. (2019). Microbiologia, cuidados e manutenção de lentes. Em lentes de contato (sexta edição). Recuperado de sciencedirect.com.
- NÓS. Biblioteca Nacional de Medicina. (2019). Clorito de sódio. Recuperado de pubchem.ncbi.nlm.nih.gov.
- Gray, N.F. (2014). Dióxido de cloro. Processo tecnológico. Em Microbiologia de Doenças Transmitidas pela Água (Segunda Edição). Recuperado de sciencedirect.com.
- McKeen, L. (2012). Introdução à Irradiação de Alimentos e Esterilização Médica. Dióxido de cloro. Em The Effect of Sterilization on Plastic and Elastomers (Terceira edição). Recuperado de sciencedirect.com.
- Ortenberg, E. e Telsch, B. (2003). Problemas de sabor e odor na água potável. In Handbook of Water and Wastewater Microbiology. Recuperado de sciencedirect.com.
- Karsa, D.R. (2007). Biocidas. Dióxido de cloro. No Manual de Limpeza / Descontaminação de Superfícies. Recuperado de sciencedirect.com.
- Cotton, F. Albert e Wilkinson, Geoffrey. (1980). Química Inorgânica Avançada. Quarta edição. John Wiley & Sons.
- Enciclopédia de Química Industrial de Ullmann. (1990). Quinta edição. VCH Verlagsgesellschaft mbH.


Ainda sem comentários