
Propriedades e usos do ácido de iodo (HIO2)

O ácido iodo É um composto químico de fórmula HIO2. Este ácido, assim como seus sais (conhecidos como ioditos), são compostos extremamente instáveis que foram observados, mas nunca isolados.
É um ácido fraco, o que significa que não se dissocia completamente. No ânion, o iodo está no estado de oxidação III e tem uma estrutura análoga ao ácido cloroso ou ácido bromo, conforme ilustrado na figura 1.
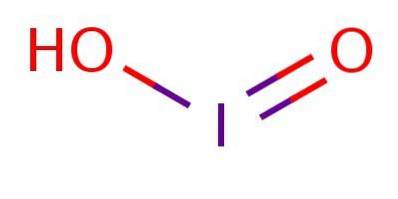
Apesar de o composto ser instável, o ácido de iodo e seus sais de iodito foram detectados como intermediários na conversão entre iodetos (I-) e iodatos (IO3-).
Sua instabilidade é devida a uma reação de dismutação (ou desproporção) para formar ácido hipoiodoide e ácido iódico, que é análogo aos ácidos cloro e bromo da seguinte maneira:
2HIO2 -> HIO + HIO3
Em Nápoles, em 1823, o cientista Luigi Sementini escreveu uma carta a E. Daniell, secretário da instituição real em Londres, onde explicava um método para a obtenção de ácido iodado.
Na carta, ele dizia que considerando que a formação do ácido nitroso se deu, combinou o ácido nítrico com o que chamou de gás nitroso (possivelmente NdoisO), o ácido de iodo poderia ser formado da mesma maneira pela reação de ácido iódico com óxido de iodo, um composto que ele havia descoberto.
Ao fazer isso, ele obteve um líquido âmbar amarelado que perdeu a cor ao entrar em contato com a atmosfera (Sir David Brewster, 1902).
Posteriormente, o cientista M. Wöhler descobriu que o ácido de Sementini é uma mistura de cloreto de iodo e iodo molecular, uma vez que o óxido de iodo usado na reação foi preparado com clorato de potássio (Brande, 1828).
Índice do artigo
- 1 Propriedades físicas e químicas
- 2 usos
- 2.1 Acilação nucleofílica
- 2.2 Reações de dismutação
- 2.3 Reações de Bray-Liebhafsky
- 3 referências
Propriedades físicas e químicas
Conforme mencionado acima, o ácido iodo é um composto instável que não foi isolado, portanto suas propriedades físicas e químicas são teoricamente obtidas por meio de cálculos computacionais e simulações (Royal Society of Chemistry, 2015).
O ácido iodo tem um peso molecular de 175,91 g / mol, uma densidade de 4,62 g / ml no estado sólido, um ponto de fusão de 110 graus centígrados (ácido iodo, 2013-2016).
Ele também tem uma solubilidade em água de 269 g / 100 ml a 20 graus Celsius (sendo um ácido fraco), tem um pKa de 0,75 e tem uma suscetibilidade magnética de −48,0 · 10−6 cm3 / mol (Centro Nacional de Biotecnologia Informação, sf).
Como o ácido iodo é um composto instável que não foi isolado, não há risco de manuseá-lo. Foi descoberto por cálculos teóricos que o ácido iodo não é inflamável..
Formulários
Acilação nucleofílica
O ácido iodo é usado como um nucleófilo em reações de acilação nucleofílica. O exemplo é dado com a acilação de trifluoroacetilos, tais como brometo de 2,2,2-trifluoroacetil, cloreto de 2,2,2-trifluoroacetil, fluoreto de 2,2,2-trifluoroacetil e iodeto de 2,2,2-trifluoroacetil para formar o iodosil 2,2,2 trifluoroacetato conforme ilustrado na figura 2.1, 2.2, 2.3 e 2.4, respectivamente.

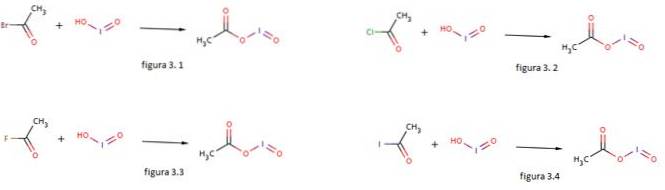
O ácido de iodo também é usado como um nucleófilo para a formação de acetato de iodosila por reação com brometo de acetila, cloreto de acetila, fluoreto de acetila e iodeto de acetila como mostrado nas figuras 3.1, 3.2, 3.3 e 3.4 respectivamente (GNU Free Documentation, sf).
Reações de dismutação
As reações de dismutação ou desproporcionamento são um tipo de reação de redução de óxido, onde a substância que é oxidada é a mesma que é reduzida.
No caso dos halogênios, por apresentarem estados de oxidação -1, 1, 3, 5 e 7, diferentes produtos das reações de dismutação podem ser obtidos dependendo das condições utilizadas..
No caso do ácido iodo, o exemplo de como ele reage para formar ácido hipoiodo e ácido iódico na forma.
2HIO2 -> HIO + HIO3
Estudos recentes analisaram a reação de dismutação do ácido iodo medindo as concentrações de prótons (H+), iodato (IO3-) e o cátion hipoiodito ácido (HdoisIO+), a fim de compreender melhor o mecanismo de dismutação do ácido de iodo (Smiljana Marković, 2015).
Uma solução foi preparada contendo as espécies intermediárias I3+. Uma mistura de iodo (I) e espécies de iodo (III) foi preparada pela dissolução de iodo (Idois) e iodato de potássio (KIO3), na proporção de 1: 5, em ácido sulfúrico concentrado (96%). Nesta solução ocorre uma reação complexa, que pode ser descrita pela reação:
eudois + 3IO3- + 8h+ -> 5IO+ + HdoisOU
Espécie I3+ eles são estáveis apenas na presença de excesso de iodato adicionado. O iodo evita a formação de I3+. O íon IO+ Obtido na forma de sulfato de iodo (IO) doisSW4), se decompõe rapidamente em solução aquosa ácida e forma I3+, representado como ácido HIOdois ou a espécie iônica IO3-. Posteriormente, foi realizada uma análise espectroscópica para determinar o valor das concentrações dos íons de interesse..
Este apresentou um procedimento para a avaliação das concentrações de pseudo-equilíbrio de hidrogênio, iodato e íons H.doisOUVI+, Espécies cinéticas e catalíticas importantes no processo de desproporção do ácido iodo, HIOdois.
Reações de Bray-Liebhafsky
Um relógio químico ou reação de oscilação é uma mistura complexa de compostos químicos em reação, em que a concentração de um ou mais componentes muda periodicamente, ou quando mudanças repentinas nas propriedades ocorrem após um tempo de indução previsível.
São uma classe de reações que servem de exemplo de termodinâmica de desequilíbrio, resultando no estabelecimento de um oscilador não linear. Eles são teoricamente importantes porque mostram que as reações químicas não precisam ser dominadas pelo comportamento termodinâmico de equilíbrio..
A reação de Bray-Liebhafsky é um relógio químico descrito pela primeira vez por William C. Bray em 1921 e é a primeira reação de oscilação em uma solução homogênea agitada..
O ácido iodado é utilizado experimentalmente para estudar este tipo de reação quando é oxidado com peróxido de hidrogênio, encontrando uma melhor concordância entre o modelo teórico e as observações experimentais (Ljiljana Kolar-Anić, 1992)..
Referências
- Brande, W. T. (1828). Um manual de química, baseado no do professor Brande. Boston: Universidade de Harvard.
- GNU Free Documentation. (s.f.). ácido iodo. Obtido em chemsink.com: chemsink.com
- ácido iodo. (2013-2016). Obtido em molbase.com: molbase.com
- Ljiljana Kolar-Anić, G. S. (1992). Mecanismo da reação de Bray-Liebhafsky: efeito da oxidação do ácido iodo pelo peróxido de hidrogênio. Chem. Soc., Faraday Trans 1992,88, 2343-2349. http://pubs.rsc.org/en/content/articlelanding/1992/ft/ft9928802343#!divAbstract
- Centro Nacional de Informações sobre Biotecnologia. (WL.). PubChem Compound Database; CID = 166623. Obtido em pubchem.com:pubchem.ncbi.nlm.nih.gov.
- Royal Society of Chemistry. (2015). Iodous acid ChemSpider ID145806. Obtido em ChemSpider: chemspider.com
- Sir David Brewster, R. T. (1902). The London and Edinburgh Philosophical Magazine and Journal of Science. Londres: Universidade de Londres.
- Smiljana Marković, R. K. (2015). Reação de desproporção de ácido iodo, HOIO. Determinação das concentrações das espécies iônicas relevantes H +, H2OI + e IO3 -.



Ainda sem comentários