
Estrutura, propriedades, usos, síntese do ácido hipocloroso (HClO)

O Ácido Hipocloroso É um composto inorgânico cuja fórmula química é HClO. Corresponde ao menos oxidado dos oxoácidos do cloro, pois contém apenas um átomo de oxigênio. Dele eles derivam o ânion hipoclorito, ClO-, e seus sais, amplamente utilizados como desinfetantes comerciais de água.
O HClO é o agente oxidante e antimicrobiano mais forte gerado quando o cloro gasoso se dissolve na água. Sua ação anti-séptica é conhecida há mais de um século, antes mesmo que as soluções de cloro fossem usadas para limpar feridas de soldados na Primeira Guerra Mundial..
A sua descoberta remonta, de facto, ao ano de 1834, pelo químico francês Antoine Jérôme Balard, que conseguiu a oxidação parcial do cloro fazendo-o borbulhar numa suspensão aquosa de óxido de mercúrio, HgO. Desde então, tem sido utilizado como desinfetante e antiviral..
Quimicamente falando, o HClO é um agente oxidante que acaba cedendo seu átomo de cloro para outras moléculas; Em outras palavras, compostos clorados podem ser sintetizados com ele, sendo as cloroaminas de grande relevância no desenvolvimento de novos antibióticos..
Na década de 1970, descobriu-se que o corpo é capaz de produzir naturalmente esse ácido por meio da ação da enzima mieloperoxidase; Enzima que atua sobre os peróxidos e ânions cloreto durante a fagocitose. Assim, do mesmo organismo pode surgir esse "matador" de intrusos, mas em uma escala inofensiva para seu próprio bem-estar..
Índice do artigo
- 1 Estrutura
- 2 propriedades
- 2.1 Acidez
- 2.2 Agente oxidante
- 2.3 Estabilidade
- 3 Síntese
- 3.1 Água e cloro
- 3.2 Eletrólise
- 4 usos
- 4.1 Aspectos gerais
- 4.2 Desinfecção e limpeza
- 5 riscos
- 6 referências
Estrutura
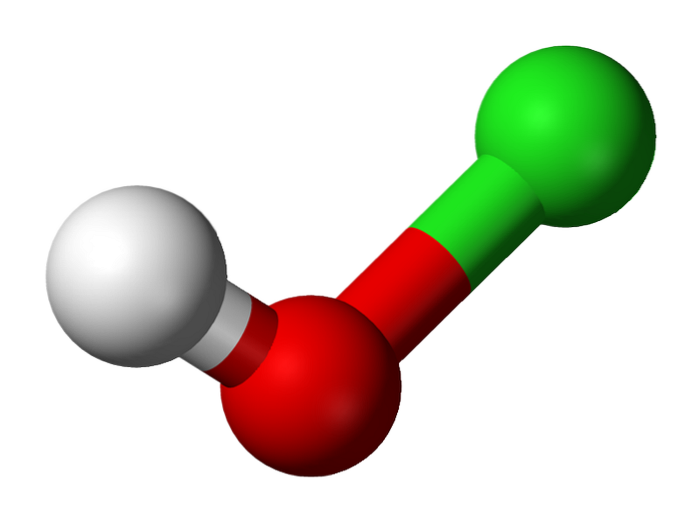
A imagem superior mostra a estrutura do HClO. Observe que a fórmula contradiz a estrutura: a molécula é H-O-Cl e não H-Cl-O; no entanto, o último é geralmente preferido para ser capaz de compará-lo diretamente com suas contrapartes mais oxidadas: HClOdois, HClO3 e HClO4.
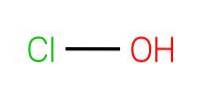
Hidrogênio ácido, H+, liberado por HClO está localizado no grupo OH ligado ao átomo de cloro. Observe também as notáveis diferenças de comprimento nas ligações O-H e Cl-O, sendo a última a mais longa devido ao menor grau de sobreposição dos orbitais do cloro, mais difusos, com os do oxigênio..
A molécula HOCl dificilmente pode permanecer estável em condições normais; não pode ser isolado de suas soluções aquosas sem ser desproporcional ou liberado como cloro gasoso, Cldois.
Portanto, não há cristais anidros (nem mesmo seus hidratos) de ácido hipocloroso; E até o momento, também não há indicação de que eles possam ser preparados por métodos extravagantes. Se pudessem se cristalizar, as moléculas de HClO interagiriam entre si por meio de seus dipolos permanentes (cargas negativas orientadas para o oxigênio).
Propriedades
Acidez
HClO é um ácido monoprótico; ou seja, você só pode doar um H+ para o meio aquoso (que é onde ele é formado):
HClO (aq) + HdoisO ↔ ClO-(ac) + H3OU+(ac) (pKa = 7,53)
A partir desta equação de equilíbrio, observa-se que uma diminuição nos íons H3OU+ (um aumento na basicidade do meio), favorece a formação de mais ânions hipoclorito, ClO-. Consequentemente, se você quiser manter uma solução de ClO relativamente estável- o pH precisa ser básico, o que é obtido com NaOH.
Sua constante de dissociação, pKa, questiona que o HClO é um ácido fraco. Portanto, ao manuseá-lo concentrado, você não teria que se preocupar tanto com os íons H3OU+, mas pelo próprio HClO (dada sua alta reatividade e não por causa de sua corrosividade).
Agente oxidante
Foi mencionado que o átomo de cloro em HClO tem um número de oxidação de +1. Isso significa que dificilmente requer o ganho de um único elétron para retornar ao seu estado fundamental (Cl0) e ser capaz de formar a molécula Cldois. Consequentemente, o HClO será reduzido a Cldois e HdoisOu, oxidando outra espécie mais rapidamente em comparação com o mesmo Cldois ou ClO-:
2HClO (aq) + 2H+ + 2e- ↔ Cldois(g) + 2HdoisO (l)
Esta reação já nos permite ver o quão estável é o HClO em suas soluções aquosas..
Seu poder oxidante não é medido apenas pela formação de Cldois, mas também por causa de sua capacidade de abandonar seu átomo de cloro. Por exemplo, pode reagir com espécies nitrogenadas (incluindo amônia e bases nitrogenadas), para produzir cloroaminas:
HClO + N-H → N-Cl + HdoisOU
Observe que uma ligação N-H de um grupo amino (-NHdois) principalmente, e é substituído por um N-Cl. O mesmo acontece com as ligações O-H dos grupos hidroxila:
HClO + O-H → O-Cl + HdoisOU
Essas reações são cruciais e explicam a ação desinfetante e antibacteriana do HClO..
Estabilidade
O HClO é instável em quase todos os lugares que você olha para ele. Por exemplo, o ânion hipoclorito é desproporcional em espécies de cloro com números de oxidação de -1 e +5, mais estável do que +1 em HClO (H+Cl+OUdois-):
3ClO-(aq) ↔ 2Cl-(ac) + ClO3-(ac)
Esta reação mudaria novamente o equilíbrio para o desaparecimento de HClO. Da mesma forma, o HClO participa diretamente em um equilíbrio paralelo com água e cloro gasoso:
Cldois(g) + HdoisO (l) ↔ HClO (aq) + H+(ac) + Cl-(ac)
É por isso que tentar aquecer uma solução de HClO para concentrá-lo (ou isolá-lo) leva à produção de Cldois, que é identificado como um gás amarelo. Da mesma forma, essas soluções não podem ser expostas à luz por muito tempo, nem à presença de óxidos metálicos, pois decompõem o Cldois (HClO desaparece ainda mais):
2Cldois + 2hdoisO → 4HCl + Odois
HCl reage com HClO para gerar mais Cldois:
HClO + HCl → Cldois + HdoisOU
E assim por diante até que não haja mais HClO.
Síntese
Água e cloro
Um dos métodos de preparação ou síntese do ácido hipocloroso já foi explicado implicitamente: dissolver cloro gasoso na água. Outro método bastante semelhante consiste em dissolver o anidrido deste ácido em água: monóxido de dicloro, CldoisOU:
CldoisO (g) + HdoisO (l) ↔ 2HClO (aq)
Novamente, não há como isolar HClO puro, uma vez que a evaporação da água mudaria o equilíbrio para a formação de CldoisOu, gás que escaparia da água.
Por outro lado, foi possível preparar soluções mais concentradas de HClO (20%) usando óxido de mercúrio, HgO. Para isso, o cloro é dissolvido em um volume de água logo no seu ponto de congelamento, de forma que se obtém um gelo clorado. Em seguida, esse mesmo gelo é mexido e, à medida que derrete, se mistura com o HgO:
2Cldois + HgO + 12HdoisO → 2HClO + HgCldois + 11hdoisOU
A solução de HClO a 20% pode finalmente ser destilada a vácuo.
Eletrólise
Um método mais simples e seguro de preparar soluções de ácido hipocloroso é usar salmouras como matéria-prima em vez de cloro. Salmouras são ricas em ânions cloreto, Cl-, que por meio de um processo de eletrólise pode ser oxidado a Cldois:
2hdoisO → Odois + 4h+ + 4e-
2Cl- ↔ 2e- + Cldois
Essas duas reações ocorrem no ânodo, onde o cloro é produzido, que imediatamente se dissolve para dar origem ao HClO; enquanto no compartimento catódico, a água é reduzida:
2hdoisO + 2e- → 2OH- + Hdois
Desta forma, o HClO pode ser sintetizado em uma escala comercial para industrial; e essas soluções obtidas a partir de salmouras são, na verdade, os produtos comercialmente disponíveis deste ácido.
Formulários
Aspectos gerais
HClO pode ser usado como um agente oxidante para oxidar álcoois em cetonas e para sintetizar cloroaminas, cloroamidas ou clorohidrinas (a partir de alcenos).
No entanto, todos os seus outros usos podem ser resumidos em uma palavra: biocida. É um assassino de fungos, bactérias, vírus e um neutralizador de toxinas liberadas por patógenos.
O sistema imunológico de nosso corpo sintetiza seu próprio HClO pela ação da enzima mieloperoxidase, ajudando os glóbulos brancos a erradicar os intrusos que causam a infecção.
Inúmeros estudos sugerem vários mecanismos de ação do HClO na matriz biológica. Isso doa seu átomo de cloro aos grupos amino de certas proteínas e também oxida seus grupos SH presentes nas pontes dissulfeto S-S, resultando em sua desnaturação..
Da mesma forma, ele interrompe a replicação do DNA ao reagir com bases nitrogenadas, afeta a oxidação completa da glicose e também pode deformar a membrana celular. Todas essas ações acabam causando a morte de germes.
Desinfecção e limpeza
É por isso que as soluções HClO acabam sendo usadas para:
-Tratamento de feridas infecciosas e gangrena
-Desinfetar o abastecimento de água
-Agente esterilizante para material cirúrgico ou ferramentas utilizadas em medicina veterinária, medicina e odontologia
-Desinfetante de qualquer tipo de superfície ou objeto em geral: barras, corrimãos, máquinas de café, cerâmicas, mesas de vidro, balcões de laboratório, etc..
-Sintetizar cloroaminas que atuam como antibióticos menos agressivos, mas ao mesmo tempo mais duráveis, específicos e estáveis do que o próprio HClO
Riscos
As soluções de HClO podem ser perigosas se forem altamente concentradas, pois podem reagir violentamente com espécies sujeitas à oxidação. Além disso, eles tendem a liberar cloro gasoso quando desestabilizados, por isso devem ser armazenados sob um protocolo de segurança rigoroso..
O HClO é tão reativo com os germes que, onde é regado, desaparece instantaneamente, sem representar risco posteriormente para quem toca nas superfícies por ele tratadas. O mesmo acontece dentro do organismo: ele se decompõe rapidamente, ou é neutralizado por qualquer espécie no ambiente biológico.
Quando gerado pelo próprio corpo, é presumível que possa tolerar baixas concentrações de HClO. No entanto, se for altamente concentrado (usado para fins sintéticos e não desinfetantes), pode ter efeitos indesejáveis ao atacar também células saudáveis (da pele, por exemplo).
Referências
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Gottardi, W., Debabov, D., & Nagl, M. (2013). N-cloraminas, uma classe promissora de anti-infecciosos tópicos bem tolerados. Agentes antimicrobianos e quimioterapia, 57 (3), 1107-1114. doi: 10.1128 / AAC.02132-12
- Por Jeffrey Williams, Eric Rasmussen e Lori Robins. (06 de outubro de 2017). Ácido hipocloroso: aproveitando uma resposta inata. Recuperado de: infecçãocontrol.tips
- Hydro Instruments. (s.f.). Química Básica de Cloração. Recuperado de: hydroinstruments.com
- Wikipedia. (2019). Ácido Hipocloroso. Recuperado de: en.wikipedia.org
- Serhan Sakarya et al. (2014). Ácido hipocloroso: um agente ideal para o tratamento de feridas com uma potente potência microbicida, antibiofilme e cicatrizante. Feridas de HMP. Recuperado de: woundsresearch.com
- PrebChem. (2016). Preparação de ácido hipocloroso. Recuperado de: prepchem.com



Ainda sem comentários