
Estrutura, propriedades, síntese e usos do ciclohexeno
O ciclohexeno é um alceno cíclico ou olefina cuja fórmula molecular é C6H10. É um líquido incolor, insolúvel em água e miscível com diversos solventes orgânicos. É caracterizado por ser inflamável e, na natureza, costuma ser encontrado no alcatrão de carvão.
O ciclohexeno é sintetizado por hidrogenação parcial do benzeno e por desidratação do álcool ciclohexanol; ou seja, uma forma mais oxidada. Como outros cicloalquenos, ele sofre reações eletrofílicas e de adição de radicais livres; por exemplo, a reação de halogenação.

Este alceno cíclico (imagem superior) forma misturas azeotrópicas (não separáveis por destilação), com álcoois inferiores e ácido acético. Não é muito estável em armazenamento prolongado, pois se decompõe sob a ação da luz solar e da radiação ultravioleta.
O ciclohexeno é utilizado como solvente e, portanto, possui inúmeras aplicações, tais como: estabilizador de gasolina de alta octanagem e para extração de óleos.
Mas o mais importante é que o ciclohexeno serve como um intermediário e matéria-prima para a obtenção de vários compostos altamente úteis, incluindo: ciclohexanona, ácido adípico, ácido maleico, ciclohexano, butadieno, ácido ciclohexilcarboxílico, etc..
Índice do artigo
- 1 Estrutura do ciclohexeno
- 1.1 Interações intermoleculares
- 2 propriedades
- 2.1 Nomes químicos
- 2.2 Peso molecular
- 2.3 Aparência física
- 2.4 Odor
- 2,5 ponto de ebulição
- 2.6 Ponto de fusão
- 2.7 Ponto de fulgor
- 2.8 Solubilidade em água
- 2.9 Solubilidade em solventes orgânicos
- 2.10 Densidade
- 2.11 Densidade de vapor
- 2.12 Pressão de vapor
- 2.13 Autoignição
- 2.14 Decomposição
- 2,15 Viscosidade
- 2.16 Calor de combustão
- 2.17 Calor de vaporização
- 2.18 Tensão superficial
- 2.19 Polimerização
- 2.20 Limiar de odor
- 2.21 Índice de refração
- 2,22 pH
- 2.23 Estabilidade
- 2.24 Reações
- 3 Síntese
- 4 usos
- 5 riscos
- 6 referências
Estrutura do ciclohexeno
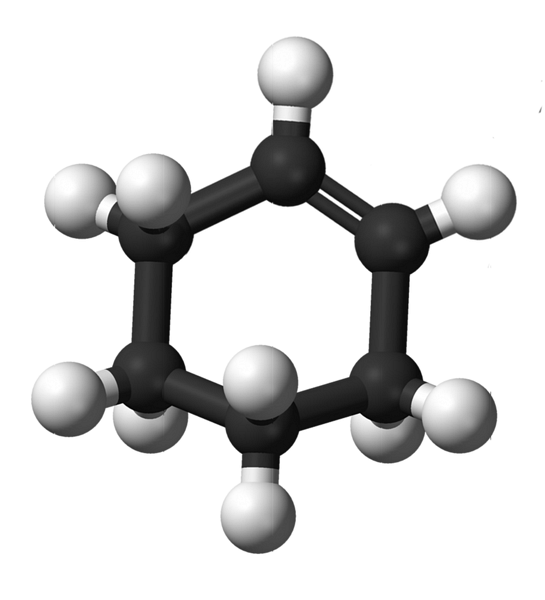
A imagem superior mostra a estrutura do ciclohexênio com um modelo de esferas e barras. Observe o anel de seis carbonos e a ligação dupla, ambas insaturações do composto. Dessa perspectiva, parece que o anel é plano; mas não é de todo.
Para começar, os carbonos da ligação dupla têm hibridização spdois, o que lhes dá uma geometria plana trigonal. Portanto, esses dois carbonos, e aqueles adjacentes a eles, estão no mesmo plano; enquanto os dois carbonos na extremidade oposta (para a ligação dupla), estão acima e abaixo do referido plano.
A imagem abaixo ilustra perfeitamente o que acaba de ser explicado.

Observe que a faixa preta é composta por quatro carbonos: os dois da ligação dupla e os outros adjacentes a eles. A perspectiva exposta é aquela que seria obtida se o espectador colocasse seu olho diretamente em frente ao vínculo duplo. Pode-se então ver que um carbono está acima e abaixo deste plano.
Como a molécula do ciclohexeno não é estática, os dois carbonos se trocarão: um descerá enquanto o outro sobe acima do plano. Então, você esperaria que essa molécula se comportasse.
Interações intermoleculares
O ciclohexeno é um hidrocarboneto e, portanto, suas interações intermoleculares são baseadas nas forças de dispersão de London.
Isso porque a molécula é apolar, sem momento de dipolo permanente, e seu peso molecular é o fator que mais contribui para mantê-la coesa no líquido..
Da mesma forma, a dupla ligação aumenta o grau de interação, uma vez que não pode se mover com a mesma flexibilidade dos outros carbonos, o que favorece a interação entre moléculas vizinhas. É por esta razão que o ciclohexeno tem um ponto de ebulição ligeiramente superior (83ºC) do que o ciclohexano (81ºC)..
Propriedades
Nomes químicos
Ciclohexeno, tetrahidrobenzeno.
Peso molecular
82,146 g / mol.
Aspecto físico
Líquido incolor.
Odor
Cheiro doce.
Ponto de ebulição
83 ºC a 760 mmHg.
Ponto de fusão
-103,5 ºC.
ponto de ignição
-7 ºC (copo fechado).
Solubilidade em água
Praticamente insolúvel (213 mg / L).
Solubilidade em solventes orgânicos
Miscível com etanol, benzeno, tetracloreto de carbono, éter de petróleo e acetona. Espera-se que seja capaz de dissolver compostos apolares, como alguns dos alótropos de carbono..
Densidade
0,810 g / cm3 a 20ºC.
Densidade do vapor
2.8 (em relação ao ar tomado como igual a 1).
Pressão de vapor
89 mmHg a 25ºC.
Autoignição
244 ºC.
Decomposição
Ele se decompõe na presença de sais de urânio, sob a ação da luz solar e da radiação ultravioleta.
Viscosidade
0,625 mPascal a 25 ºC.
Calor de combustão
3.751,7 kJ / mol a 25 ºC.
Calor da vaporização
30,46 kJ / mol a 25 ºC.
Tensão superficial
26,26 mN / m.
Polimerização
Pode polimerizar sob certas condições.
Limiar de odor
0,6 mg / m3.
Índice de refração
1,4465 a 20 ºC.
pH
7-8 a 20ºC.
Estabilidade
O ciclohexeno não é muito estável durante o armazenamento de longo prazo. A exposição à luz e ao ar pode levar à produção de peróxidos. Também é incompatível com agentes oxidantes fortes..
Reações
-Os cicloalquenos sofrem principalmente reações de adição, tanto eletrofílicas quanto com radicais livres.
-Reage com o bromo para formar 1,2-dibromociclohexano.
-Oxida rapidamente na presença de permanganato de potássio (KMnO4).
-É capaz de produzir um epóxido (óxido de ciclohexeno) na presença de ácido peroxibenzóico.
Síntese
O ciclohexeno é produzido por catálise ácida de ciclohexanol:
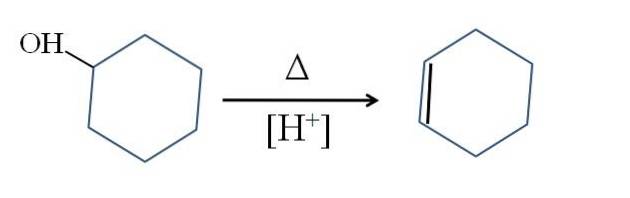
O símbolo Δ representa o calor necessário para promover a saída do grupo OH como uma molécula de água em meio ácido (-OHdois+).
O ciclohexeno também é produzido pela hidrogenação parcial do benzeno; ou seja, duas de suas ligações duplas adicionam uma molécula de hidrogênio:
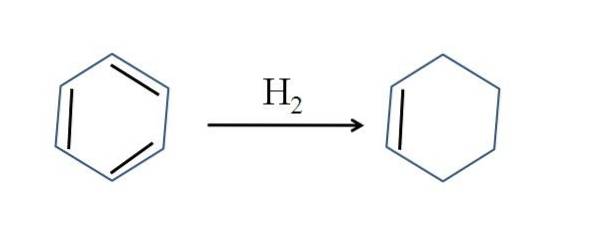
Embora a reação pareça simples, requer grandes pressões de Hdois e catalisadores.
Formulários
-Tem utilidade como solvente orgânico. Além disso, é uma matéria-prima para a produção de ácido adípico, aldeído adípico, ácido maleico, ciclohexano e ácido ciclohexilcarboxílico..
-É utilizado na produção de cloreto de ciclohexano, composto utilizado como intermediário na fabricação de produtos farmacêuticos e aditivo de borracha.
-O cicloexeno também é utilizado na síntese da cicloexanona, matéria-prima para a produção de medicamentos, pesticidas, perfumes e corantes..
-O ciclohexeno está envolvido na síntese de aminociclohexanol, um composto que é usado como surfactante e emulsificante.
-Além disso, o ciclohexeno pode ser usado para a preparação laboratorial de butadieno. Este último composto é utilizado na fabricação de borracha sintética, na fabricação de pneus de automóveis e também na fabricação de plásticos acrílicos..
-O ciclohexeno é uma matéria-prima para a síntese de lisina, fenol, resina de policicloolefina e aditivos de borracha.
-É usado como estabilizador para gasolina de alta octanagem.
-Intervém na síntese de revestimentos impermeáveis, filmes resistentes a rachaduras e aglutinantes de ligação para revestimentos.
Riscos
O ciclohexeno não é um composto muito tóxico, mas pode causar vermelhidão da pele e dos olhos ao entrar em contato. A inalação pode causar tosse e sonolência. Além disso, sua ingestão pode causar sonolência, falta de ar e náuseas..
O ciclohexeno é pouco absorvido pelo trato gastrointestinal, portanto, efeitos sistêmicos graves não são esperados da ingestão. A complicação máxima é sua aspiração pelo sistema respiratório, o que pode causar pneumonia química.
Referências
- Joseph F. Chiang e Simon Harvey Bauer. (1968). Estrutura molecular do ciclohexeno. J. Am. Chem. Soc.. 1969, 91, 8, 1898-1901.
- Karry Barnes. (2019). Ciclohexeno: perigos, síntese e estrutura. Estudar. Recuperado de: study.com
- Morrison, R. T. e Boyd, R. N. (1987). Quimica Organica. (5ta Edição.). Editorial Addison-Wesley Iberoamericana.
- PubChem. (2019). Ciclohexeno. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Livro Químico. (2019). Ciclohexeno. Recuperado de: chemicalbook.com
- Rede de dados toxicológicos. (2017). Ciclohexeno. Toxnet. Recuperado de: toxnet.nlm.nih.gov
- Chemoxy. (s.f.). A fórmula estrutural do ciclohexeno é. Recuperado de: chemoxy.com



Ainda sem comentários