
Estrutura, propriedades, riscos, usos do cianeto de sódio (NaCN)

O Cianeto de sódio é um sal inorgânico formado por um cátion sódio Na+ e um ânion cianeto CN-. Sua fórmula química é NaCN. Também conhecido como cianeto de sódio, é um sólido cristalino branco. É higroscópico, ou seja, absorve água do meio ambiente, e seus cristais são cúbicos como cloreto de sódio NaCl.
Quando dissolvido em água, tende a formar cianeto de hidrogênio HCN. Suas soluções dissolvem ouro e prata facilmente. Essa característica o torna usado para extrair ouro e prata de seus minerais. As soluções utilizadas para este fim são recicladas, ou seja, são reaproveitadas diversas vezes.

No entanto, parte do cianeto consegue escapar para alguns tanques de resíduos, o que representa um perigo para a vida selvagem e para os humanos, uma vez que o cianeto é muito tóxico e pode causar a morte..
O NaCN é usado na indústria química como um intermediário para preparar vários tipos de compostos, como tinturas, produtos químicos agrícolas e drogas ou medicamentos..
O cianeto de sódio é um composto muito perigoso, pois pode causar a morte, por isso deve ser manuseado com extrema cautela.
Índice do artigo
- 1 Estrutura
- 2 Nomenclatura
- 3 propriedades
- 3.1 Estado físico
- 3.2 Peso molecular
- 3.3 Ponto de fusão
- 3.4 Ponto de ebulição
- 3,5 ponto de fulgor
- 3,6 Densidade
- 3.7 Solubilidade
- 3.8 Constante de dissociação
- 3,9 pH
- 3.10 Propriedades químicas
- 4 riscos
- 5 Obtendo
- 6 usos
- 6.1 Na extração de minerais de ouro e prata. Consequências
- 6.2 Na produção de outros compostos químicos
- 6.3 Na indústria de metal
- 6.4 Em outros usos
- 6.5 Aplicativos fora de uso, questionados ou muito raros
- 7 referências
Estrutura
O cianeto de sódio é composto de um íon Na + e um íon CN-.
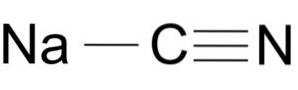
O íon cianeto tem um átomo de carbono C e um átomo de nitrogênio N ligados entre si por uma ligação tripla..
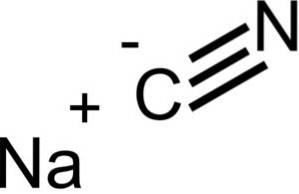
NaCN tem a mesma estrutura cristalina do NaCl, então seus cristais são cúbicos.
Nomenclatura
-Cianeto de sódio
-Cianeto de sódio
Propriedades
Estado físico
Sólido cristalino branco higroscópico (absorve água do meio ambiente).
Peso molecular
49,007 g / mol
Ponto de fusão
563,7 ºC
Ponto de ebulição
1496 ºC
Ponto de inflamação
Não é inflamável. Mas se exposto ao fogo, cianeto de hidrogênio HCN e óxidos de nitrogênio são produzidos..
Densidade
1.595 g / cm3 a 20 ºC
Solubilidade
Muito solúvel em água: 48 g / 100 mL a 10ºC, 82 g / 100 mL a 35ºC. Ligeiramente solúvel em álcool
Constante de dissociação
É hidrolisado em solução aquosa gerando cianeto de hidrogênio HCN. A constante desta hidrólise é Kh = 2,5 x 10-5.
pH
Soluções aquosas de NaCN são fortemente alcalinas
Propriedades quimicas
Quando dissolvido em água, ele se separa em íons de Na+ e CN-. Em solução aquosa, o íon cianeto CN- pegue um próton H+ de água HdoisOu formando HCN e um íon OH-, então a solução se torna alcalina.
CN- + HdoisO → HCN + OH-
Por esse motivo, suas soluções aquosas se decompõem rapidamente quando armazenadas, formando o cianeto de hidrogênio HCN..
É corrosivo para o alumínio. Suas soluções dissolvem facilmente ouro Au e prata Ag na presença de ar..
É um agente quelante já que o ânion cianeto CN- pode se ligar facilmente a outros metais, como prata, ouro, mercúrio, zinco, cádmio, etc..
Tem um leve odor de amêndoa amarga.
Riscos
Deve ser manuseado com muito cuidado. É um composto altamente tóxico, inibe processos metabólicos importantes e leva à morte por ingestão, inalação, absorção pela pele ou contato com os olhos..
Se inalado, o NaCN se dissolve na mucosa do trato respiratório e passa para a corrente sanguínea. O íon cianeto do NaCN tem forte afinidade pelo ferro no estado de oxidação +3, ou seja, o cátion férrico Fe3+.
Quando o cianeto é absorvido, ele reage rapidamente com o Fe3+ de uma importante enzima da mitocôndria das células (citocromo oxidase), impedindo certos processos da respiração deste.
Portanto, a respiração celular é inibida ou desacelerada e resulta em hipóxia citotóxica. Isso significa que as células e tecidos são incapazes de usar oxigênio, especialmente as células do cérebro e do coração.
Desta forma, ocorrem danos permanentes ou letais ao corpo. Isso pode ocorrer tanto em humanos quanto em animais..
Se ingerido, causa congestão dos vasos sanguíneos e corrosão da mucosa gástrica, além dos já mencionados.

Não é combustível, mas em contato com ácidos libera HCN, que é altamente inflamável e tóxico.
Se derreter com nitritos ou cloratos, pode explodir.
Obtendo
Pode ser obtido com sódio Na, amônia NH3 e carbono C. O sódio reage com a amônia para dar amida de sódio NaNHdois:
2 Na + 2 NH3 → 2 NaNHdois + Hdois↑
A amida de sódio é aquecida com carvão a 600 ° C e produz cianamida de sódio NadoisNCN, que é então convertido em cianeto de sódio com carvão a 800 ºC:
2 NaNHdois + C → 2 Hdois↑ + NadoisNCN
N / DdoisNCN + C → 2 NaCN
Outro método é derreter cianamida de cálcio CaNCN e carbono C com carbonato de sódio NadoisCO3:
CaNCN + C + NadoisCO3 → CaCO3 + 2 NaCN
Ele também pode ser preparado passando o gás nitrogênio Ndois por uma mistura quente de carbonato de sódio NadoisCO3 e carbono em pó C, usando ferro Fe como catalisador ou acelerador de reação:
N / DdoisCO3 + 4 C + Ndois → 2 NaCN + 3 CO ↑
Formulários
Na extração de minerais de ouro e prata. Consequências
O cianeto de sódio é usado há muito tempo para extrair os metais ouro e prata de seus minérios..
O cianeto usado no processo é reciclado, mas algo escapa para a lagoa de resíduos junto com os metais pesados não recuperados.
Pássaros, morcegos e outros animais que bebem dessas lagoas de cianeto foram envenenados.
Há registros de uma barragem na Romênia que isolou um tanque de resíduos e foi danificada por um evento climático..
Como consequência, toneladas de cianeto foram lançadas no rio Sasar e em sistemas de aqüíferos próximos, como os rios Lapus, Somes e Tisza, terminando no Danúbio..
Isso causou uma cascata de mortes de animais, ou em outras palavras, um desastre ecológico..

Na produção de outros compostos químicos
O cianeto de sódio NaCN é usado na síntese de vários tipos de compostos orgânicos.
Por exemplo, são preparados pigmentos e corantes (incluindo branqueadores ópticos), compostos para uso na agricultura ou agroquímicos e vários produtos farmacêuticos..
Também é usado para obter agentes quelantes ou sequestrantes de íons metálicos..
Compostos chamados nitrilos são preparados com cianeto de sódio NaCN, que quando tratado com solução aquosa ácida ou alcalina quente permite a obtenção de ácidos carboxílicos.
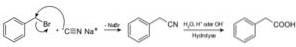
Permite preparar ácidos graxos com grupos ciano, cianetos de metais pesados e ácido cianídrico ou cianeto de hidrogênio HCN.
Na industria do metal
NaCN é usado em soluções usadas em galvanoplastia ou galvanoplastia de metais (revestimento de metais com outros), por exemplo zinco.
É um componente de aço temperado. Também atua na limpeza de metais.
Em outros usos
O cianeto de sódio é um intermediário na fabricação de náilon.
Serve para separação de minerais por flotação de espuma.
Aplicativos fora de uso, questionados ou muito raros
NaCN foi usado para matar roedores, como coelhos e ratos, e suas tocas, e para matar ninhos de cupins.
Atualmente é usado ocasionalmente para eliminar coiotes, raposas e cães selvagens. Usado na forma de cápsula em doses únicas ou múltiplas em pastagens, campos de caça e florestas.
Devido à sua extrema toxicidade, o NaCN deve ser usado apenas por indivíduos treinados..
Este uso é considerado muito perigoso para os humanos, mas ainda há quem o use.

Na agricultura, antigamente era usado para fumigar árvores de frutas cítricas e outras frutas. Também foi utilizado como inseticida e miticida (eliminador de ácaros) para ser aplicado após a colheita, em frutas cítricas não armazenadas ou na fumigação de caminhões usados para transportá-los. Também foi usado para fumigar navios, vagões e armazéns..
Todos esses usos foram questionados devido à alta toxicidade do cianeto de sódio. Por este motivo, já não é utilizado ou é muito raro e sob condições muito controladas..
Referências
- NÓS. Biblioteca Nacional de Medicina. (2019). Cianeto de sódio. Recuperado de pubchem.ncbi.nlm.nih.gov.
- Kirk-Othmer (1994). Enciclopédia de Tecnologia Química. Quarta edição. John Wiley & Sons.
- Hurst, H.E. e Martin, M.D. (2017). Toxicologia. Cianeto. Em Pharmacology and Therapeutics for Dentistry (Seventh Edition). Recuperado de sciencedirect.com.
- Coppock, R.W. e Dziwenka, M. (2015). Ameaças à vida selvagem por agentes de guerra química. Em Handbook of Toxicology of Chemical Warfare Agents (Segunda Edição). Recuperado de sciencedirect.com.
- Morrison, R.T. e Boyd, R.N. (2002). Química orgânica. 6ª Edição. Prentice-Hall.



Ainda sem comentários