
Base, preparação e uso de ágar de farinha de milho

O ágar de fubá é um meio de cultura sólido, com baixo poder nutricional, útil para o subcultivo de certos fungos e para a demonstração de clamidósporos em cepas do complexo. Candida albicans. Em inglês é conhecido como Corn Meal Agar..
O meio convencional de fubá tem uma composição muito simples, contém fubá, ágar-ágar e água. Devido ao seu baixo nível nutricional, é ideal para uso na manutenção de cepas de fungos por períodos moderados de tempo, especialmente fungos pretos..
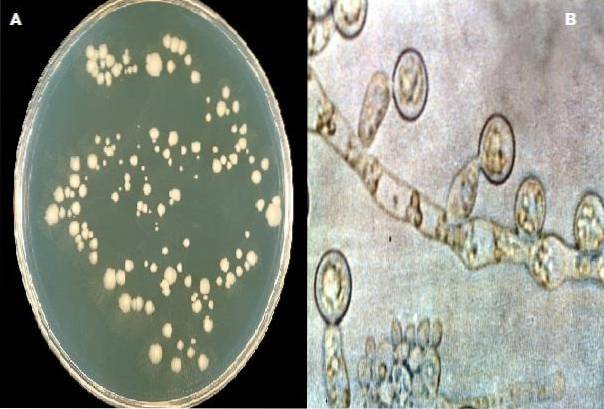
Esporulação do complexo Candida albicans é favorecido neste meio, se 1% de Tween 80 é adicionado durante a preparação do ágar. A formação de clamidósporos é característica dessa espécie e praticamente a única que afeta o homem..
Existem outras espécies que formam clamidósporos, mas é improvável que afetem os seres humanos, como Candida australis, presente em excrementos de pinguim, ou C. clausenii, que é um saprófito raramente encontrado. Da mesma forma, excepcionalmente a espécie C. stellatoidea Y C. tropicalis poderia formá-los.
Por outro lado, a adição de glicose ao meio de fubá favorece a formação de pigmentos nas cepas de Trichophytom rubrum.
É importante observar que existem fungos que não formam hifas ou pseudo-hifas no ágar de farinha de milho, como Cryptococcus neoformans, diferenciando-se de outros gêneros.
O ágar de fubá pode ser feito em casa no laboratório ou também podem ser usados meios comerciais..
Índice do artigo
- 1 justificativa
- 2 Preparação
- 2.1 Agar comercial de farinha de milho
- 2.2 Agar de farinha de milho com Tween 80
- 2.3 Agar de farinha de milho com glicose
- 3 Use
- 3.1 Semeando
- 3.2 Demonstração de clamidosporos
- 3.3 Manutenção de cepas de fungos
- 4 Controle de qualidade
- 5 limitações
- 6 referências
Base
A farinha de milho é o substrato, o ágar é o agente de solidificação e a água é o solvente..
O ágar de farinha de milho pode ser suplementado com tween 80 (monooleato de sorbitano ou poliéster polissorbato 80). Este composto reduz a tensão superficial do meio devido ao seu poder emulsificante.
Também cria um ambiente hostil que inibe a multiplicação celular exagerada e estimula o crescimento de hifas, favorecendo também a produção de clamidósporos; o último considerado estruturas de resistência. Essa estrutura auxilia na identificação das espécies de Candida albicans.
Por sua vez, a glicose neste meio aumenta a capacidade de formação de pigmentos de alguns fungos..
Deve-se notar que a farinha de milho com glicose média não serve para demonstrar clamidósporos em cComplexo de Candida albicans.
Preparação
Preparação de ágar de fubá caseiro
Pesar 47 g de farinha de milho amarela e dissolver em 500 ml de água destilada. Aquecer a 60 ºC, mexendo sempre a preparação por um período de aproximadamente 1 hora. Em seguida, filtre com um pedaço de gaze e algodão, opcionalmente pode ser filtrado novamente passando a preparação por um papel de filtro Whatman nº 2.
Completar o volume para 1000 ml com água destilada. Adicione 17 g de ágar-ágar, aqueça até dissolver. Autoclave por 15 minutos a 121 ºC.
Sirva em placas de Petri esterilizadas. Manter na geladeira.
A cor do meio preparado é esbranquiçada com aparência irregular.
Se desejar preparar farinha de milho com glicose para a preparação descrita acima, adicione 10 g de glicose.
Agar comercial de farinha de milho
Pesar 17 g do meio desidratado e dissolver em 1 litro de água destilada. A mistura pode ser aquecida, agitando suavemente para dissolver completamente. Esterilizar em autoclave a 121 ºC, a 15 lb, por 15 minutos.
Despeje em placas de Petri estéreis. Vamos solidificar. Inverta e guarde na geladeira até o uso. Temperar antes de usar.
O pH deve ser 6,0 ± 0,2 a 25 ºC.
Agar de farinha de milho com Tween 80
Para cumprir a ISO 18416, o ágar de fubá deve ser preparado da seguinte forma:
Pesar 65 gramas por litro e adicionar 10 ml de Tween 80. Aqueça e ferva por alguns minutos até dissolver, tomando cuidado para não aquecer demais. Esterilizar a 121 ºC por 15 minutos.
Agar de farinha de milho com glicose
Para aumentar o poder cromogênico das colônias de Trichophyton rubrum e diferenciá-los de T. mentagrophytes, 0,2% de glicose pode ser adicionado à fórmula original. Você não precisa ter Tween 80, pois a glicose inibe a formação de clamidósporos.
Usar
Principalmente, o uso do ágar farinha de milho destina-se ao estudo de cepas de Candida, auxiliando na sua identificação através da observação característica de clamidósporos nas espécies albicans. Ou seja, o uso desse ágar serve como método auxiliar na identificação dessas leveduras..
Ambas as espécies saprofíticas e patogênicas podem se desenvolver neste ágar, mas cada uma forma estruturas miceliais características. Por exemplo, espécies do gênero Torulopsis não produzem micélio e se reproduzem apenas por blastoconídios..
Da mesma forma, as espécies Trichosporon e Geotrichum produzem artroconídios em ágar de farinha de milho e às vezes é difícil distinguir entre um e outro..
Os artroconídios do gênero Geotrichum produzem uma extensão das hifas que lembra um taco de hóquei..
Além disso, a produção de pigmentos usando ágar de farinha de milho suplementado com glicose é útil na identificação de Trichophytom rubrum.
Semeado
Colônias suspeitas de Candida obtidas no meio de cultura primário - ágar Sabouraud - de amostras clínicas, cosméticos, solos, entre outros, são subcultivadas em ágar farinha de milho. O meio é semeado e incubado a 22 ° C durante 24 a 48 horas. O tempo de incubação pode ser prolongado, se necessário.
Demonstração de clamidosporo
Para tanto, o ágar de farinha de milho com Tween 80 deve ser inoculado pela técnica de Dalmau. Esse método consiste em pegar uma porção da colônia suspeita com o cabo de platina e fazer três cortes paralelos no meio, mantendo o cabo a 45º. Os cortes devem ser separados por uma distância de 1 cm um do outro.
Posteriormente, um objeto de cobertura previamente inflamado é colocado sobre as estrias que foram semeadas, de modo que metade seja coberta e a outra descoberta.
Incubar as placas semeadas a 30 ° C por 48-72 h e, em seguida, examinar microscopicamente através da lamínula..
Manutenção de cepas de fungos
Para a manutenção das cepas, as placas semeadas e cultivadas são armazenadas em geladeira (4 a 8 ºC). Desta forma, podem durar várias semanas e ser usados para fins de ensino ou pesquisa..
Controle de qualidade
Para o controle de esterilidade, uma placa é incubada sem inoculação em temperatura ambiente, espera-se que não haja crescimento ou alteração de cor.
Para controle de qualidade, cepas conhecidas como: Staphylococcus aureus, ATCC 6538, Escherichia coli ATCC 25922, Aspergillus niger ATCC 16404, Candida albicans ATCC 1023, Saccharomyces cerevisiae ATCC 9763.
Os resultados esperados são inibição parcial para S. aureus Y E. coli. Embora seja esperado um crescimento satisfatório no resto das cepas.
Aspergillus niger cresce com colônias pretas e esporuladas em um tempo aproximado de 5 dias de incubação.
Candida albicans colônias de leveduras com produção de clamidosporos.
Saccharomyces cerevisiae produzir grandes células de levedura.
Limitações
No fundo da placa forma-se um precipitado amarelo que não deve ser confundido com colônias..
Referências
- Neogen Laboratories. Agar de farinha de milho. Disponível em: foodsafety.neogen.com.
- Culture Media Microkit. Agar de farinha de milho. Disponível em: Medioscultivo.com.
- Linares M, Solís F. Guia de Identificação de Leveduras. Disponível em: http: //www.guia.revibero.
- Urcia F, Guevara M. Rev. Perú Med.Exp. Saúde Pública, 2002; 19 (4): 206-208. Disponível em: Scielo.com
- Casas-Rincón G. Micologia Geral. 1994. 2ª Ed. Universidade Central da Venezuela, Edições da Biblioteca. Venezuela Caracas.
- Forbes B, Sahm D, Weissfeld A. (2009). Bailey & Scott Microbiological Diagnosis. 12 ed. Editorial Panamericana S.A. Argentina.
- Koneman E, Allen S, Janda W., Schreckenberger P, Winn W. (2004). Diagnóstico microbiológico. 5ª ed. Editorial Panamericana S.A. Argentina.
- Castillo E. Estudo comparativo de alguns métodos macro e microscópicos de isolamento e reconhecimento do gênero Candida. Rev. Colombiana de Ciências Farmacêuticas Químicas. 1970; 3 (1): 33-57. Disponível em: Ciencias.unal.edu.co



Ainda sem comentários