
Base, preparação e uso de ágar EMB
O Ágar EMB é um meio de cultura sólido seletivo e diferencial utilizado para o isolamento de bacilos Gram negativos, principalmente da família Enterobacteriaceae, e outros bacilos Gram negativos não fastidiosos. Também é conhecido pela sigla EAM, que significa eosina-azul de metileno..
Este meio foi criado por Holt-Harris e Teague em 1916. Ele contém peptona, lactose, sacarose, fosfato dipotássico, ágar, eosina, azul de metileno e água. É muito semelhante ao Agar MacConkey, especialmente ao usar o Agar EMB Modificado de Levine, que não contém sacarose..
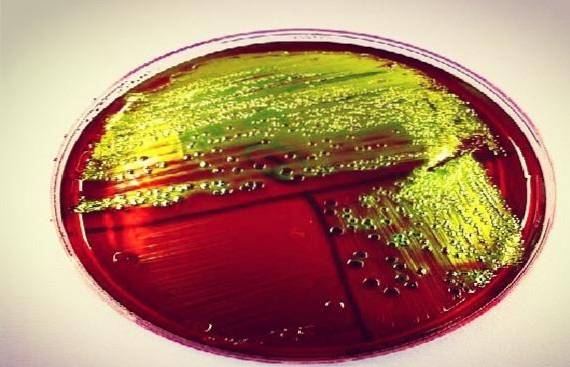
Na verdade, cada laboratório decide se trabalhará com um ou com o outro, pois cumprem a mesma função, embora bioquimicamente sejam diferentes..
Ele ainda tem a mesma desvantagem do ágar MacConkey clássico em termos de produção de enxameação pelo gênero Proteus. Portanto, para evitar esse fenômeno, a concentração do ágar pode ser aumentada em até 5%..
Índice do artigo
- 1 justificativa
- 1.1 Seletiva
- 1.2 Diferencial
- 2 Preparação
- 3 usos
- 4 Controle de qualidade
- 5 Considerações finais
- 6 referências
Base
Seletivo
O ágar EMB é sutilmente seletivo porque contém os corantes de anilina (eosina e azul de metileno), que atuam como inibidores, evitando o crescimento da maioria das bactérias Gram positivas e de alguns fastidiosos bastonetes Gram negativos..
No entanto, este ágar tem a desvantagem de que algumas bactérias Gram positivas podem resistir à presença de substâncias inibidoras e crescer como pequenas colônias incolores pontuais, como Enterococcus faecalis e alguns Estafilococo.
Certas leveduras também podem crescer, como Complexo de Candida albicans, o que resultará em colônias rosa muito pequenas. Os clamidósporos podem até desenvolver-se a partir desta levedura se a amostra for profundamente semeada..
Diferencial
Por outro lado, o ágar EMB também é um meio diferencial, uma vez que esses corantes juntos (eosina e azul de metileno) têm a propriedade de formar um precipitado em pH ácido, portanto, servem como indicadores de sua produção..
Assim, bactérias fermentadoras de lactose ou sacarose fracamente produzem colônias roxas em 24 a 48 horas. Por exemplo, os gêneros Klebsiella, Enterobacter e Serratia.
As bactérias que fermentam fortemente a lactose, como Escherichia coli, ou sacarose, como Yersinia enterocolitica ou Proteus penneri, formam um precipitado preto-esverdeado, dando uma aparência de brilho metálico característico nessas espécies.
Deve-se notar que se o meio EMB levina (sem sacarose) for usado, Yersinia enterocolitica Y Proteus penneri irá produzir colônias claras.
As bactérias que não fermentam lactose ou sacarose são nutridas pela presença de peptonas, que fornecem os aminoácidos e o nitrogênio necessários para o crescimento bacteriano e produzem colônias claras. Por exemplo, os gêneros Salmonella e Shigella, entre outros.
Da mesma forma, é importante observar que o gênero Acinetobacter pode apresentar colônias de azul lavanda, embora não seja fermentador de lactose ou sacarose, mas tem a propriedade de fixar o azul de metileno em sua parede celular. Isso também pode acontecer com outras bactérias oxidativas.
Preparação
O meio desidratado original é bege claro.
Para a preparação desse meio de cultura, 36 gramas do meio desidratado devem ser pesados e suspensos em um frasco contendo um litro de água destilada..
Após deixar a mistura repousar por 5 minutos, leve o frasco a uma fonte de calor, mexendo vigorosa e constantemente até ferver e se dissolver completamente..
Posteriormente, o meio de cultura já dissolvido deve ser esterilizado em autoclave a 121 ° C por 15 minutos..
Ao final do tempo, é retirado da autoclave e deixado para descansar um pouco. Em seguida, ainda quente (45-50 ° C), 15-20 ml de ágar é servido em cada placa de Petri estéril. O meio deve ser azul tornassol.
Depois de servir, as placas são deixadas levemente descobertas até que o ágar esfrie ligeiramente. Eles são então cobertos e podem se solidificar completamente. Em seguida, são encomendados em porta-pratos invertidos e armazenados em geladeira (8 ° C) até o uso..
Este procedimento é realizado preferencialmente em uma capela de fluxo laminar ou na frente do queimador de Bunsen para evitar contaminação.
É importante lembrar que cada casa comercial indicará a quantidade a ser pesada para o preparo do meio de cultura..
O pH final do meio deve ser 7,2 ± 0,2
Formulários
Este meio é utilizado para semear urina e fezes ou qualquer tipo de espécime clínico, principalmente se houver suspeita da presença de bacilos Gram-negativos não fastidiosos, como os bacilos da família Enterobacteriaceae, que crescem muito bem neste meio..
Bactérias enteropatogênicas dos gêneros Shigella e Salmonella são diferenciadas por suas colônias incolores ou ligeiramente âmbar.
Outros bacilos não fermentadores de lactose também crescem, como Aeromonas, Pseudomonas, Acinetobacter, entre outros..
Da mesma forma, este meio é muito útil na análise microbiológica de alimentos e água, pois é ideal para a fase completa de confirmação da determinação de coliformes, ou seja, para comprovar a presença de coliformes. E. coli de caldos EC turvos, da técnica do número mais provável (NMP).
Controle de qualidade
Para verificar se o meio de cultura recém-preparado funciona bem, as cepas de controle podem ser plantadas para observar as características das colônias e verificar se elas dão conforme o esperado..
Para isso, as cepas ATCC ou cepas bem identificadas de E. coli, Enterobacter aerogenes, Klebsiella sp, Salmonella typhimurium, Shigella flexneri, Pseudomonas aeruginosa e algumas bactérias Gram positivas, como S. aureus.
Espera-se que E. coli Gera colônias pretas azuladas bem desenvolvidas com brilho metálico verde. Em tanto que, Enterobacter aerogenes Y Klebsiella sp eles devem dar colônias de muco preto-azulado bem desenvolvidas.
Por sua parte, Salmonella typhimurium Y Shigella flexneri, deve desenvolver colônias grandes, incolores ou ligeiramente âmbar.
Finalmente o gênero Pseudomonas aeruginosa cresce como colônias incolores de tamanho irregular, enquanto as bactérias Gram positivas devem ser totalmente inibidas ou crescer esparsamente com colônias muito pequenas.
Pensamentos finais
Às vezes, a esterilização faz com que o azul de metileno seja reduzido, apresentando uma cor laranja médio. Para que o azul de metileno oxide e recupere a cor roxa, ele deve ser misturado suavemente até que a cor seja recuperada..
Além disso, após a esterilização, o corante pode precipitar, por isso deve ser bem misturado antes de servir as placas de Petri..
Referências
- Camacho A, Giles M, Ortegón A, Palao M, Serrano B e Velázquez O. 2009. Técnicas de Análise Microbiológica de Alimentos. 2ª ed. Faculdade de Química da UNAM. México.
- Carranza C, León R, Falcón N, Neumann A, Kromm C. Caracterização e distribuição de cepas de Escherichia coli Potencialmente patogênico isolado de frangos de corte de granjas avícolas no Peru. Rev. investiga. veterinario. Peru 2012 23 (2): 209-219. Disponível em: scielo.org.
- Laboratorios Conda S.A. Agar Eosina e Azul de Metileno. 2010. Disponível em: condalab.com
- Britannia Laboratories. Levine E.M.B (com eosina e azul de metileno) 2011. Disponível em: britanialab.com
- Laboratórios BD. BD EMB Agar (Eosin Methylene Blue Agar), Modificado. 2013. Disponível em: bd.com
- Koneman E, Allen S, Janda W., Schreckenberger P, Winn W. (2004). Diagnóstico microbiológico. (5ª ed.). Argentina, Editorial Panamericana S.A.
- Forbes B, Sahm D, Weissfeld A. 2009. Bailey & Scott Microbiological Diagnosis. 12 ed. Argentina. Editorial Panamericana S.A


Ainda sem comentários