
Estrutura, propriedades, usos do acetonitrila (C2H3N)
O acetonitrila É uma substância de origem orgânica composta apenas por carbono, hidrogênio e nitrogênio. Esta espécie química pertence ao grupo das nitrilas, sendo a acetonitrila a que apresenta estrutura mais simples dentre as do tipo orgânico..
Os nitrilos são uma classe de compostos químicos cuja estrutura é constituída por um grupo cianeto (CN-) e uma cadeia radical (-R). Esses elementos são representados pela seguinte fórmula geral: R-C≡N.
Sabe-se que essa substância é originada principalmente durante a produção de outra espécie chamada acrilonitrila (outra nitrila simples, de fórmula molecular C3H3N, que é utilizado na fabricação de produtos da indústria têxtil) como um subproduto do mesmo.
Além disso, o acetonitrila é considerado um solvente com propriedades de polaridade média, por isso é usado com bastante regularidade em análises de RP-HPLC (cromatografia líquida de alta eficiência de fase reversa)..
Índice do artigo
- 1 Estrutura
- 2 propriedades
- 3 usos
- 4 riscos
- 5 referências
Estrutura
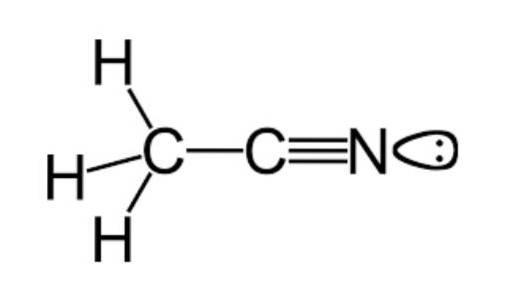
Conforme mencionado anteriormente, a acetonitrila pertence ao grupo funcional das nitrilas, possuindo uma fórmula molecular comumente representada como CdoisH3N, que pode ser visto na fórmula estrutural que é exemplificada na figura superior.
Esta imagem mostra uma espécie de lóbulo ligado ao átomo de nitrogênio, que representa o par de elétrons desemparelhados que este átomo possui, e que lhe confere grande parte das propriedades de reatividade e estabilidade que são características dele..
Desta forma, esta espécie apresenta um comportamento bastante particular devido ao seu arranjo estrutural, que se traduz em fraqueza para receber ligações de hidrogênio e pouca capacidade de doar elétrons..
Além disso, essa substância se originou pela primeira vez na segunda metade da década de 1840, sendo fabricada pelo cientista Jean-Baptiste Dumas, de nacionalidade francesa..
A conformação estrutural desta substância permite-lhe ter as características de um solvente próprio de natureza orgânica..
Por sua vez, esta propriedade permite que o acetonitrilo seja misturado com a água, bem como com uma série de outros solventes de origem orgânica, com exceção dos hidrocarbonetos ou espécies de hidrocarbonetos do tipo saturado..
Propriedades
Este composto possui uma série de propriedades que o distinguem de outros de sua mesma classe, que estão listadas abaixo:
- Está em um estado líquido de agregação sob condições padrão de pressão e temperatura (1 atm e 25 ° C).
- Sua configuração molecular confere-lhe uma massa molar ou peso molecular de aproximadamente 41 g / mol.
- É considerada como a nitrila que possui a estrutura mais simples, dentre as do tipo orgânico..
- Suas propriedades ópticas permitem que seja incolor nesta fase líquida e com características límpidas, além de possuir um odor aromático..
- Tem um ponto de inflamação de cerca de 2 ° C, que é equivalente a 35,6 ° F ou 275,1 K.
- Tem um ponto de ebulição na faixa de 81,3 a 82,1 ° C, uma densidade de aproximadamente 0,786 g / cm3 e um ponto de fusão que está entre -46 a -44 ° C.
- É menos denso que a água, mas miscível com ela e com uma variedade de solventes orgânicos.
- Ele exibe uma constante dielétrica de 38,8, além de um momento de dipolo de aproximadamente 3,92 D.
- É capaz de dissolver uma grande variedade de substâncias de origem iônica e de natureza apolar..
- É amplamente utilizado como uma fase móvel em análise de HPLC, que tem propriedades de alta inflamabilidade.
Formulários
Entre o grande número de aplicações que o acetonitrila tem, podem ser contados os seguintes:
- Da mesma forma, outras espécies de nitrilas podem sofrer um processo de metabolização em microssomas (elementos vesiculares que fazem parte do fígado), principalmente neste órgão, para produzir ácido cianídrico..
- É amplamente utilizado como fase móvel no tipo de análise denominado cromatografia líquida de alta eficiência de fase reversa (RP-HPLC); ou seja, como uma substância eluente que possui alta estabilidade, grande poder de eluição e baixa viscosidade.
- No caso de aplicações de magnitude industrial, esse composto químico é utilizado nas refinarias de petróleo como solvente em determinados processos, como a purificação do alceno denominado butadieno..
- É também utilizado como ligante (espécie química que se combina com um átomo de um elemento metálico, considerado central em determinada molécula, para formar um composto ou complexo de coordenação) em um grande número de compostos nitrílicos com metais do grupo de transição.
- Da mesma forma, é usado em síntese orgânica para um grande número de produtos químicos vantajosos como ácido α-naftaleno acético, tiamina ou cloridrato de acetamidina..
Riscos
Os riscos associados à exposição ao acetonitrila são diversos. Entre elas está a diminuição da toxicidade quando a exposição é por um período de tempo reduzido e em pequenas quantidades, sendo metabolizada para a produção de ácido cianídrico..
Da mesma forma, raramente foram registrados casos de pessoas envenenadas por esta espécie química, envenenadas pelo cianeto presente na molécula após terem entrado em contato com a acetonitrila em diferentes graus (quando inalado, ingerido ou absorvido pela pele).
Por esse motivo, as consequências de sua toxicidade são retardadas, pois o organismo não metaboliza facilmente essa substância em cianeto, pois leva de duas a doze horas para que isso ocorra..
No entanto, o acetonitrila é facilmente absorvido dos pulmões e do trato gastrointestinal. Posteriormente, sua distribuição ocorre por todo o corpo, acontecendo nas pessoas e até mesmo nos animais e atingindo os rins e o baço..
Por outro lado, além dos riscos de inflamabilidade que apresenta, a acetonitrila é um precursor de substâncias tão tóxicas como o ácido cianídrico ou o formaldeído. Seu uso em produtos da área cosmética foi até proibido no chamado Espaço Econômico Europeu em 2000..
Referências
- Wikipedia. (s.f.). Acetonitrila. Obtido em en.wikipedia.org
- PubChem. (s.f.). Acetonitrila. Recuperado de pubchem.ncbi.nlm.nih.gov
- Brown, P. R. (2000). Avanços em cromatografia. Obtido em books.google.co.ve
- ScienceDirect. (s.f.). Acetonitrila. Obtido em sciencedirect.com
- ChemSpider. (s.f.). Acetonitrila. Obtido em chemspider.com



Ainda sem comentários